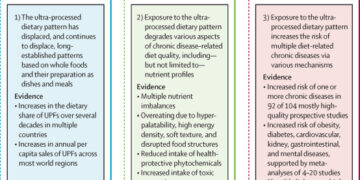
Han pasado casi tres años desde que la revista Journal 1 publicó los resultados del estudio 076 del AIDS Clinical Trials Group (ACTG), el primer ensayo controlado aleatorio en el que se demostró que una intervención reducía la incidencia de la infección por el virus de la inmunodeficiencia humana (VIH). El fármaco antirretroviral zidovudina, administrado por vía oral a mujeres embarazadas VIH positivas en Estados Unidos y Francia, administrado por vía intravenosa durante el parto y posteriormente administrado a los recién nacidos, redujo la incidencia de la infección por VIH en dos tercios. 2 El régimen puede salvar la vida de uno de cada siete bebés nacidos de mujeres infectadas por el VIH.
Debido a estos hallazgos, el estudio se dio por terminado en el primer análisis intermedio y dentro de los dos meses después de que se anunciaron los resultados, el Servicio de Salud Pública convocó una reunión y concluyó que el régimen ACTG 076 debería recomendarse para todas las mujeres embarazadas VIH positivas sin exposición previa sustancial a zidovudina y debería considerarse para otras mujeres embarazadas VIH positivas caso por caso. 3 De este modo, el estándar de atención para las mujeres embarazadas VIH positivas pasó a ser el régimen ACTG 076.
En los Estados Unidos, tres estudios recientes de práctica clínica informan que el uso del régimen ACTG 076 está asociado con disminuciones del 50 por ciento o más en la transmisión perinatal del VIH. 4–6 Pero en los países en desarrollo, especialmente en Asia y África subsahariana, donde se proyecta que para el año 2000, 6 millones de mujeres embarazadas estarán infectadas con el VIH, 7 el potencial del régimen ACTG 076 sigue sin aprovecharse, principalmente debido al costo exorbitante del medicamento en la mayoría de los países.
Es evidente que es deseable un régimen menos costoso que el ACTG 076 pero igualmente eficaz, tanto en los países en desarrollo como en los industrializados. Pero ha habido incertidumbre sobre qué diseño de investigación utilizar en la búsqueda de un régimen menos costoso. En junio de 1994, la Organización Mundial de la Salud (OMS) convocó a un grupo en Ginebra para evaluar la agenda de investigación sobre la transmisión perinatal del VIH a raíz del ACTG 076. El grupo, que no incluía a ningún especialista en ética, concluyó: “Los ensayos controlados con placebo ofrecen la mejor opción para una evaluación rápida y científicamente válida de regímenes alternativos de medicamentos antirretrovirales para prevenir la transmisión [perinatal] del VIH”. 8 Este documento inédito ha sido ampliamente citado como justificación para ensayos posteriores en países en desarrollo. En nuestra opinión, la mayoría de estos ensayos son poco éticos y conducirán a cientos de infecciones por VIH prevenibles en bebés.
Basándonos principalmente en documentos obtenidos de los Centros para el Control y la Prevención de Enfermedades (CDC), hemos identificado 18 ensayos controlados aleatorizados de intervenciones para prevenir la transmisión perinatal del VIH que comenzaron a incluir pacientes después de que se completara el estudio ACTG 076 o que aún no han comenzado a incluir pacientes. Los estudios están diseñados para evaluar una variedad de intervenciones: medicamentos antirretrovirales como la zidovudina (generalmente en regímenes que son menos costosos o complejos que el régimen ACTG 076), vitamina A y sus derivados, lavado vaginal intraparto y globulina inmunológica contra el VIH, una forma de inmunoterapia. Estos ensayos involucran a un total de más de 17.000 mujeres.
En los dos estudios que se están realizando en Estados Unidos, los pacientes de todos los grupos de estudio tienen acceso sin restricciones a zidovudina u otros fármacos antirretrovirales. Sin embargo, en 15 de los 16 ensayos en países en desarrollo, algunos o todos los pacientes no reciben fármacos antirretrovirales. Nueve de los 15 estudios que se están realizando fuera de Estados Unidos están financiados por el gobierno estadounidense a través de los CDC o los Institutos Nacionales de Salud (NIH), cinco están financiados por otros gobiernos y uno está financiado por el Programa de las Naciones Unidas contra el SIDA. Los estudios se están realizando en Costa de Marfil, Uganda, Tanzania, Sudáfrica, Malawi, Tailandia, Etiopía, Burkina Faso, Zimbabwe, Kenia y la República Dominicana. Estos 15 estudios violan claramente las recientes directrices diseñadas específicamente para abordar las cuestiones éticas relacionadas con los estudios en países en desarrollo. Según estas directrices, «las normas éticas aplicadas no deben ser menos exigentes que las que serían en el caso de la investigación realizada en el país [patrocinador]». 9 Además, las normas estadounidenses que rigen los estudios realizados con fondos federales en el país o en el extranjero especifican que los procedimientos de investigación no deben “exponer innecesariamente a los sujetos a riesgos”. 10
El estudio número 16 es digno de mención tanto como modelo de un estudio realizado éticamente que intenta identificar regímenes antirretrovirales menos costosos como una indicación de cuán fuerte es la ortodoxia del ensayo controlado con placebo. En 1994, Marc Lallemant, un investigador de la Escuela de Salud Pública de Harvard, solicitó fondos del NIH para un estudio de equivalencia en Tailandia en el que se compararían tres regímenes más cortos de zidovudina con un régimen similar al utilizado en el estudio ACTG 076. Un estudio de equivalencia se realiza típicamente cuando un régimen particular ya ha demostrado ser efectivo y uno está interesado en determinar si un segundo régimen es aproximadamente igual de efectivo pero menos tóxico o costoso. 11 La sección de estudios del NIH presionó repetidamente a Lallemant y a la Escuela de Salud Pública de Harvard para que realizaran un ensayo controlado con placebo, lo que llevó al director del comité de sujetos humanos de Harvard a responder: “La realización de un ensayo controlado con placebo para [zidovudina] en mujeres embarazadas en Tailandia sería poco ético e inaceptable, ya que un ensayo controlado con un fármaco activo es factible”. 12 El NIH finalmente cedió y el estudio ya está en marcha. Dado que los nueve estudios de medicamentos antirretrovirales han atraído la mayor atención, nos centraremos en ellos en este artículo.
Hacer la pregunta de investigación equivocada
Existen numerosos puntos de acuerdo entre quienes realizan o defienden estos estudios controlados con placebo en los países en desarrollo y quienes se oponen a ellos. Ambas partes coinciden en que la transmisión perinatal del VIH es un problema grave que merece una atención internacional concertada; que el ensayo ACTG 076 fue un gran avance en la prevención del VIH perinatal; que la investigación sobre este tema tiene un papel que desempeñar en los países en desarrollo; que la identificación de intervenciones menos costosas y de eficacia similar sería de enorme beneficio, dados los recursos limitados para la atención médica en la mayoría de los países en desarrollo; y que los estudios aleatorios pueden ayudar a identificar esas intervenciones.
El único punto de desacuerdo es cuál es el mejor grupo de comparación que se puede utilizar para evaluar la eficacia de intervenciones menos costosas una vez que se ha identificado una intervención eficaz. Los investigadores que llevan a cabo los ensayos controlados con placebo afirman que estos ensayos representan el único diseño de investigación adecuado, lo que implica que responden a la pregunta: “¿Es el régimen más corto mejor que nada?”. Nosotros adoptamos la visión más optimista de que, dadas las conclusiones del ACTG 076 y otra información clínica, los investigadores son perfectamente capaces de diseñar un régimen antirretroviral más corto que sea aproximadamente tan eficaz como el régimen ACTG 076. La propuesta para el estudio de Harvard en Tailandia plantea claramente la pregunta de investigación: “¿Podemos reducir la duración del tratamiento profiláctico [con zidovudina] sin aumentar el riesgo de transmisión perinatal del VIH, es decir, sin comprometer la eficacia demostrada del régimen estándar ACTG 076 [con zidovudina]?”. Creemos que estos estudios de equivalencia de regímenes antirretrovirales alternativos proporcionarán resultados aún más útiles que los ensayos controlados con placebo, sin las muertes de cientos de recién nacidos que son inevitables si se utilizan grupos placebo.
En una reciente audiencia del Congreso sobre ética de la investigación, se le preguntó al director del NIH, Harold Varmus, cómo el Departamento de Salud y Servicios Humanos podía financiar tanto un ensayo controlado con placebo (a través del CDC) como un estudio de equivalencia no controlado con placebo (a través del NIH) en Tailandia. El Dr. Varmus admitió que los estudios controlados con placebo “no son la única manera de lograr resultados”. 14 Si la investigación se puede realizar satisfactoriamente de más de una manera, ¿por qué no seleccionar el enfoque que minimice la pérdida de vidas?
Análisis inadecuado de los datos de ACTG 076 y otras fuentes
Los NIH, los CDC, la OMS y los investigadores que realizan los estudios que consideramos poco éticos argumentan que las diferencias en la duración y la vía de administración de los agentes antirretrovirales en los regímenes más cortos, en comparación con el régimen ACTG 076, justifican el uso de un grupo placebo. 15-18 Dado que ACTG 076 fue un ensayo controlado aleatorio bien realizado, es preocupante que los abundantes datos disponibles del estudio no fueran utilizados adecuadamente por el grupo reunido por la OMS en junio de 1994, que recomendó ensayos controlados con placebo después de ACTG 076, o por los investigadores de los 15 estudios que consideramos poco éticos.
De hecho, los investigadores del ACTG 076 realizaron un análisis de subgrupos para identificar un período apropiado para la administración de zidovudina antes del parto. La duración media aproximada del tratamiento antes del parto fue de 12 semanas. En una comparación del tratamiento durante 12 semanas o menos (promedio, 7) con el tratamiento durante más de 12 semanas (promedio, 17), no hubo asociación univariante entre la duración del tratamiento y su efecto en la reducción de la transmisión perinatal del VIH (P = 0,99) (Gelber R: comunicación personal). Este análisis está algo limitado por el número de lactantes infectados y su naturaleza post hoc. Sin embargo, cuando se combina con información como el hecho de que en las poblaciones que no amamantan se estima que el 65 por ciento de los casos de infección perinatal por VIH se transmiten durante el parto y el 95 por ciento de los casos restantes se transmiten dentro de los dos meses posteriores al parto, 19 el análisis sugiere que los regímenes más cortos pueden ser igualmente eficaces. Este hallazgo debería haber sido explorado en estudios posteriores asignando aleatoriamente a las mujeres a regímenes de tratamiento más largos o más cortos.
¿Qué hay del argumento de que el uso de la vía oral para la administración intraparto de zidovudina en los ensayos actuales (en contraposición a la vía intravenosa en ACTG 076) justifica el uso de un placebo? En sus protocolos para sus dos estudios en Tailandia y Costa de Marfil, el CDC reconoció que “datos previos de modelos farmacocinéticos sugieren que los niveles séricos de [zidovudina] obtenidos con esta dosis [oral] serán similares a los niveles obtenidos con una infusión intravenosa”. 20
Por lo tanto, sobre la base de los datos del ACTG 076, el conocimiento sobre el momento de la transmisión perinatal y los datos farmacocinéticos, los investigadores deberían haber tenido todas las razones para creer que los regímenes más cortos bien diseñados serían más eficaces que el placebo. Estos hallazgos alteran seriamente el equilibrio (incertidumbre sobre el resultado probable del estudio) necesario para justificar un ensayo controlado con placebo por razones éticas. 21
Definición del placebo como estándar de atención en los países en desarrollo
Algunos funcionarios e investigadores han defendido el uso de estudios controlados con placebo en países en desarrollo, argumentando que los sujetos reciben un tratamiento al menos de acuerdo con el estándar de atención en esos países, que consiste en regímenes no probados o ningún tratamiento en absoluto. Esta afirmación revela una incomprensión fundamental del concepto de estándar de atención. En los países en desarrollo, el estándar de atención (en este caso, no proporcionar zidovudina a mujeres embarazadas seropositivas) no se basa en una consideración de tratamientos alternativos o datos clínicos previos, sino que es, en cambio, una política determinada económicamente por los gobiernos que no pueden permitirse los precios fijados por las compañías farmacéuticas. Estamos de acuerdo con el Consejo de Organizaciones Internacionales de Ciencias Médicas en que los investigadores que trabajan en países en desarrollo tienen la responsabilidad ética de proporcionar un tratamiento que se ajuste al estándar de atención en el país patrocinador, cuando sea posible. 9 Una excepción sería un estándar de atención que exigiera un gasto exorbitante, como el costo de construir una unidad de cuidados coronarios. Dado que el fabricante suele ofrecer zidovudina gratuitamente para su uso en ensayos clínicos, el costo excesivo no es un factor en este caso. La aceptación de un estándar de atención que no se ajusta al estándar del país patrocinador da lugar a una doble moral en la investigación. Esa doble moral, que permite diseños de investigación que son inaceptables en el país patrocinador, crea un incentivo para utilizar como sujetos de investigación a quienes tienen menos acceso a la atención sanitaria.
¿Cuáles son las posibles consecuencias de aceptar semejante doble rasero? Los investigadores podrían inyectar parásitos vivos de la malaria a sujetos VIH positivos en China para estudiar el efecto sobre la progresión de la infección por VIH, aunque el protocolo del estudio haya sido rechazado en Estados Unidos y México. O los investigadores podrían asignar aleatoriamente a los san (bosquimanos) desnutridos para que recibieran pan fortificado con vitaminas o pan común. También se podrían justificar los ensayos de vacunas contra el VIH en los que a los sujetos no se les proporcionara condones o asesoramiento de última generación sobre sexo seguro argumentando que no se proporciona habitualmente en los países en desarrollo en cuestión. No se trata simplemente de escenarios hipotéticos del peor caso posible; los dos primeros estudios ya se han realizado, 22,23 y el tercero ha sido propuesto y criticado. 24
Annas y Grodin comentaron recientemente sobre la caracterización y justificación de los placebos como un estándar de atención: “‘Nada’ es una descripción de lo que sucede; ‘estándar de atención’ es un estándar normativo de tratamiento médico efectivo, ya sea que se proporcione o no a una comunidad en particular”. 25
Justificando los ensayos controlados con placebo afirmando que son más rápidos
Los investigadores también han tratado de justificar los ensayos controlados con placebo argumentando que requieren menos sujetos que los estudios de equivalencia y, por lo tanto, pueden completarse más rápidamente. Debido a que los estudios de equivalencia simplemente se ocupan de excluir intervenciones alternativas que caen por debajo de un nivel preestablecido de eficacia (en lugar de establecer qué intervención es superior), es habitual utilizar pruebas estadísticas unilaterales en tales estudios. 11 El número de mujeres necesarias para un ensayo controlado con placebo y un estudio de equivalencia es similar. 26 En un ensayo controlado con placebo de un tratamiento corto con zidovudina, con tasas de transmisión perinatal del VIH del 25 por ciento en el grupo placebo y del 15 por ciento en el grupo zidovudina, se necesitarían 500 sujetos con un nivel alfa de 0,05 (bilateral) y un nivel beta de 0,2. Un estudio de equivalencia con una tasa de transmisión del 10 por ciento en el grupo que recibió el régimen ACTG 076, una diferencia de eficacia del 6 por ciento (por encima del 10 por ciento), un nivel alfa de 0,05 (unilateral) y un nivel beta de 0,2 requeriría 620 sujetos (McCarthy W: comunicación personal).
Hacia un único estándar internacional de ética en la investigación
Los investigadores asumen mayores responsabilidades éticas cuando inscriben sujetos en estudios clínicos, un precepto reconocido por Varmus recientemente cuando insistió en que a todos los sujetos de un ensayo de intercambio de agujas patrocinado por los NIH se les ofreciera la vacuna contra la hepatitis B. 27 Los residentes de países empobrecidos y poscoloniales, la mayoría de los cuales son personas de color, deben ser protegidos de la posible explotación en la investigación. De lo contrario, el estado abominable de la atención médica en esos países puede usarse para justificar estudios que nunca podrían pasar la prueba ética en el país patrocinador.
Con la creciente globalización del comercio, la escasez de fondos gubernamentales para la investigación y la mayor atención que se presta a los peligros que plantean las “infecciones emergentes” para los residentes de los países industrializados, es probable que aumenten los estudios en los países en desarrollo. Es hora de desarrollar estándares de investigación que impidan los tipos de dobles raseros evidentes en estos ensayos. En un editorial publicado hace nueve años en el Journal, Marcia Angell afirmó: “Los sujetos humanos en cualquier parte del mundo deben estar protegidos por un conjunto irreductible de estándares éticos ” . 28 Trágicamente, para los cientos de bebés que han contraído innecesariamente la infección por VIH en los estudios de transmisión perinatal que ya se han completado, cualquier protección de ese tipo habrá llegado demasiado tarde.
Referencias
1.
Connor, EM, Sperling, RS, Gelber, R, et al. Reducción de la transmisión maternoinfantil del virus de inmunodeficiencia humana tipo 1 con tratamiento con zidovudina. N Engl J Med 1994;331:1173-1180
2.
Sperling, RS, Shapiro, DE, Coombs, RW, et al. Carga viral materna, tratamiento con zidovudina y riesgo de transmisión del virus de inmunodeficiencia humana tipo 1 de madre a hijo. N Engl J Med 1996;335:1621-1629
3.
Recomendaciones del Grupo de Trabajo del Servicio de Salud Pública de los Estados Unidos sobre el uso de zidovudina para reducir la transmisión perinatal del virus de la inmunodeficiencia humana. MMWR Morb Mortal Wkly Rep 1994;43:1-20
4.
Fiscus, SA, Adimora, AA, Schoenbach, VJ, et al. Infección por VIH perinatal y efecto de la terapia con zidovudina en la transmisión en condados rurales y urbanos. JAMA 1996;275:1483-1488
5.
Cooper E, Diaz C, Pitt J, et al. Impacto de ACTG 076: uso de zidovudina durante el embarazo y cambios en la tasa de transmisión vertical del VIH. En: Programa y resúmenes de la Tercera Conferencia sobre Retrovirus e Infecciones Oportunistas, Washington, DC, 28 de enero–1 de febrero de 1996. Washington, DC: Sociedad de Enfermedades Infecciosas de Estados Unidos, 1996:57.
6.
Simonds RJ, Nesheim S, Matheson P, et al. Reducción de la transmisión del VIH de madre a hijo siguiendo las recomendaciones de ZDV perinatal. Presentado en la 11.ª Conferencia Internacional sobre el SIDA, Vancouver, Canadá, 7 al 12 de julio de 1996. Resumen.
7.
Scarlatti, G. Infección pediátrica por VIH. Lancet 1996;348:863-868
8.
Recomendaciones de la reunión sobre la transmisión del VIH de madre a hijo mediante el uso de antirretrovirales, Ginebra, Organización Mundial de la Salud, 23 al 25 de junio de 1994.
9.
Organización Mundial de la Salud. Directrices éticas internacionales para la investigación biomédica en seres humanos. Ginebra: Consejo de Organizaciones Internacionales de las Ciencias Médicas, 1993.
10.
45 CFR 46.111(a)(1).
11.
Prueba de equivalencia de dos proporciones binomiales. En: Machin D, Campbell MJ. Tablas estadísticas para el diseño de ensayos clínicos. Oxford, Inglaterra: Blackwell Scientific, 1987:35-53.
12.
Brennan TA. Carta a Gilbert Meier, División de Ética en Investigación de los NIH, 28 de diciembre de 1994.
13.
Lallemant M, Vithayasai V. Un curso breve de ZDV para prevenir el VIH perinatal en Tailandia. Boston: Harvard School of Public Health, 28 de abril de 1995.
14.
Varmus H. Testimonio ante el Subcomité de Recursos Humanos, Comité de Reforma y Supervisión Gubernamental, Cámara de Representantes de Estados Unidos, 8 de mayo de 1997.
15.
Puntos de discusión del borrador: respuesta a la conferencia de prensa de Public Citizen. Comunicado de prensa de los Institutos Nacionales de Salud, 22 de abril de 1997.
16.
Preguntas y respuestas: Estudios de los CDC sobre el uso de AZT para prevenir la transmisión del VIH de madre a hijo en países en desarrollo. Comunicado de prensa de los Centros para el Control y la Prevención de Enfermedades, Atlanta. (Documento sin fecha.)
17.
Preguntas y respuestas sobre los ensayos patrocinados por ONUSIDA para la prevención de la transmisión de madre a hijo: documento informativo para ayudar a responder a las cuestiones planteadas por el público y los medios de comunicación. Comunicado de prensa del Programa de las Naciones Unidas sobre el SIDA. (Documento sin fecha.)
18.
Halsey NA, Meinert CL, Ruff AJ, et al. Carta a Harold Varmus, Director de los Institutos Nacionales de Salud. Baltimore: Johns Hopkins University, 6 de mayo de 1997.
19.
Wiktor SZ, Ehounou E. Un estudio de intervención aleatorizado y controlado con placebo para evaluar la seguridad y la eficacia de la zidovudina oral administrada al final del embarazo para reducir la incidencia de la transmisión del VIH-1 de madre a hijo en Abiyán, Costa de Marfil. Atlanta: Centros para el Control y la Prevención de Enfermedades. (Documento sin fecha).
20.
Rouzioux, C, Costagliola, D, Burgard, M, et al. El momento de la transmisión del VIH-1 de madre a hijo depende del estado materno. AIDS 1993;7:Suppl 2:S49-S52
21.
Freedman, B. Equipoise y la ética de la investigación clínica. N Engl J Med 1987;317:141-145
22.
Heimlich HJ, Chen XP, Xiao BQ, et al. Respuesta de CD4 en pacientes VIH positivos tratados con terapia antipalúdica. Presentado en la 11.ª Conferencia Internacional sobre el SIDA, Vancouver, BC, 7-12 de julio de 1996. Resumen.
23.
Bishop, WB, Laubscher, I, Labadarios, D, Rehder, P, Louw, ME, Fellingham, SA. Efecto del pan enriquecido con vitaminas en el estado vitamínico de una comunidad rural aislada: un ensayo clínico controlado. S Afr Med J 1996;86:Suppl:458-462
24.
Lurie, P, Bishaw, M, Chesney, MA, et al. Aspectos éticos, conductuales y sociales de los ensayos de vacunas contra el VIH en países en desarrollo. JAMA 1994;271:295-301
25.
Annas G, Grodin M. Una disculpa no es suficiente. Boston Globe. 18 de mayo de 1997:C1-C2.
26.
Freedman, B, Weijer, C, Glass, KC. Ortodoxia del placebo en la investigación clínica. I. Mitos empíricos y metodológicos. J Law Med Ethics 1996;24:243-251
27.
Varmus H. Comentarios en la reunión del Comité Asesor del Director de los Institutos Nacionales de Salud, 12 de diciembre de 1996.
28.
Angell, M. ¿Imperialismo ético? Ética en la investigación clínica colaborativa internacional. N Engl J Med 1988;319:1081-1083