Introducción
Métodos
Descripción general
Datos de entrada
| 1990–2009 | 2010–2021 | Unidades de tamaño de muestra | |||
|---|---|---|---|---|---|
| Número de estudios-ubicación GBD-años | Tamaño de la muestra | Número de estudios-ubicación GBD-años | Tamaño de la muestra | ||
| Causas múltiples de muerte | 1996 | 71 766 533 | 1503 | 66 804 957 | Fallecidos |
| Alta hospitalaria | 508 | 5 052 412 | 805 | 4 999 065 | Descargas |
| Reclamaciones de seguros para pacientes ambulatorios y hospitalizados | 0 | 0 | 8 | 20 991 554 | Visitas y admisiones |
| Datos microbianos o de laboratorio con resultados | 359 | 1 325 029 | 995 | 17 646 602 | Aislamientos |
| Datos microbianos o de laboratorio sin resultado | 1038 | 13 681 797 | 3009 | 97 863 850 | Aislamientos |
| Estudios de literatura | 3321 | 4 400 616 | 1545 | 3 010 191 | Casos o aislamientos |
| Perfiles de resistencia a fármacos individuales | 816 | 49 563 600 | 1482 | 161 875 741 | Aislamientos |
| Ventas farmacéuticas | 883 | 883 | 829 | 829 | Años de estudio en el país |
| Uso de antibióticos entre niños menores de 5 años que informaron estar enfermos | 134 | 57 171 | 207 | 200 498 | Hogares encuestados |
| Vigilancia de la mortalidad (toma de muestras de tejido mínimamente invasivas de la Vigilancia de la Salud Infantil y la Prevención de la Mortalidad) | 0 | 0 | 37 | 2460 | Aislamientos |
| Vinculación (sólo mortalidad) | 27 | 204 736 | 11 | 83 579 | Fallecidos |
| Datos de entrada de causa de muerte | 5130 | 469 412 517 | 1436 | 232 349 574 | Fallecidos |
| Años | Base de datos de causas de muerte de GBD (paso 0) * | Modelos de sepsis y síndrome infeccioso (paso 1) | Tasa de letalidad (paso 2) | Distribución de patógenos (paso 3) | Prevalencia de resistencia (paso 4) | Riesgo relativo (paso 5) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Número de muertes | Fracción de países representados | Número de muertes | Fracción de países representados | Número de casos | Fracción de países representados | Número de casos | Fracción de países representados | Número de casos | Fracción de países representados | Número de casos | Fracción de países representados | ||
| América Latina Andina | 1990–2009 | 3 820 911 | 3 de 3 | . | . | 3480 | 2 de 3 | 63 243 | 3 de 3 | 121 066 | 3 de 3 | 65 964 | 3 de 3 |
| 2010–2021 | 1 465 590 | 3 de 3 | . | . | 80 | 1 de 3 | 2365 | 2 de 3 | 227 755 | 3 de 3 | 26 900 | 3 de 3 | |
| Australasia | 1990–2009 | 4 528 250 | 2 de 2 | 149 697 | 1 de 2 | 80 275 | 1 de 2 | 25 998 | 2 de 2 | 2 164 774 | 2 de 2 | 150 952 | 2 de 2 |
| 2010–2021 | 1 622 390 | 2 de 2 | 167 840 | 1 de 2 | 277 427 | 2 de 2 | 398 308 | 2 de 2 | 3 396 867 | 2 de 2 | 592 851 | 2 de 2 | |
| caribe | 1990–2009 | 4 558 782 | 19 de 19 | . | . | 19 251 | 2 de 19 | 62 456 | 5 de 19 | 173 074 | 5 de 19 | 133 113 | 5 de 19 |
| 2010–2021 | 1 418 887 | 19 de 19 | . | . | 8432 | 3 de 19 | 6102 | 4 de 19 | 60 279 | 6 de 19 | 30 272 | 5 de 19 | |
| Asia central | 1990–2009 | 11 961 820 | 9 de 9 | 66 771 | 3 de 9 | 4887 | 1 de 9 | 81 972 | 6 de 9 | 101 408 | 3 de 9 | 59 934 | 3 de 9 |
| 2010–2021 | 3 794 666 | 9 de 9 | . | . | . | . | 2234 | 2 de 9 | 5949 | 5 de 9 | 4596 | 2 de 9 | |
| Europa central | 1990–2009 | 33 212 410 | 13 de 13 | . | . | 1 171 088 | 10 de 13 | 3 797 792 | 10 de 13 | 3 120 201 | 12 de 13 | 3 628 021 | 12 de 13 |
| 2010–2021 | 11 429 450 | 13 de 13 | . | . | 275 296 | 10 de 13 | 114 245 | 10 de 13 | 880 145 | 10 de 13 | 1 066 039 | 8 de 13 | |
| América Latina central | 1990–2009 | 23 751 460 | 9 de 9 | 2 987 071 | 2 de 9 | 525 174 | 9 de 9 | 76 286 | 8 de 9 | 1 046 062 | 9 de 9 | 466 049 | 9 de 9 |
| 2010–2021 | 11 011 570 | 9 de 9 | 11 787 179 | 2 de 9 | 1 453 094 | 8 de 9 | 1 467 114 | 9 de 9 | 22 822 424 | 9 de 9 | 16 158 315 | 9 de 9 | |
| África subsahariana central | 1990–2009 | 4120 | 5 de 6 | . | . | . | . | 430 | 4 de 6 | 28 331 | 5 de 6 | 24 855 | 4 de 6 |
| 2010–2021 | 1213 | 5 de 6 | . | . | . | . | . | . | 1734 | 3 de 6 | 139 | 2 de 6 | |
| Asia oriental | 1990–2009 | 13 921 440 | 3 de 3 | 249 992 | 1 de 3 | 154 863 | 2 de 3 | 66 516 | 2 de 3 | 1 501 542 | 2 de 3 | 860 165 | 2 de 3 |
| 2010–2021 | 53 581 700 | 3 de 3 | 1 079 267 | 1 de 3 | 907 562 | 2 de 3 | 530 432 | 2 de 3 | 2 152 800 | 2 de 3 | 1 738 085 | 2 de 3 | |
| Europa Oriental | 1990–2009 | 71 077 680 | 7 de 7 | . | . | 470 286 | 5 de 7 | 203 816 | 6 de 7 | 669 146 | 7 de 7 | 876 947 | 7 de 7 |
| 2010–2021 | 25 203 530 | 7 de 7 | . | . | 33 732 | 3 de 7 | 18 594 | 5 de 7 | 157 873 | 5 de 7 | 168 981 | 4 de 7 | |
| África subsahariana oriental | 1990–2009 | 228 636 | 14 de 15 | . | . | 1 003 | 1 de 15 | 7610 | 10 de 15 | 133 681 | 11 de 15 | 88 268 | 8 de 15 |
| 2010–2021 | 27 948 | 14 de 15 | 625 | 3 de 15 | 19 466 | 4 de 15 | 43 724 | 11 de 15 | 354 548 | 13 de 15 | 273 361 | 12 de 15 | |
| Asia Pacífico con altos ingresos | 1990–2009 | 33 180 280 | 4 de 4 | . | . | 417 693 | 3 de 4 | 194 837 | 3 de 4 | 121 845 396 | 4 de 4 | 121 983 482 | 4 de 4 |
| 2010–2021 | 15 927 180 | 4 de 4 | . | . | 97 050 | 2 de 4 | 20 951 | 3 de 4 | 1 325 127 | 4 de 4 | 1 343 243 | 4 de 4 | |
| América del Norte con altos ingresos | 1990–2009 | 73 876 250 | 3 de 3 | 56 181 023 | 1 de 3 | 1 808 900 | 2 de 3 | 3 296 180 | 2 de 3 | 1 326 754 | 2 de 3 | 1 288 451 | 2 de 3 |
| 2010–2021 | 29 459 200 | 3 de 3 | 28 502 039 | 1 de 3 | 29 965 525 | 2 de 3 | 3 894 238 | 2 de 3 | 51 880 035 | 2 de 3 | 38 539 427 | 2 de 3 | |
| África del Norte y Oriente Medio | 1990–2009 | 4 450 410 | 21 de 21 | 62 401 | 2 de 21 | 700 309 | 13 de 21 | 490 458 | 19 de 21 | 2 962 227 | 21 de 21 | 3 003 646 | 21 de 21 |
| 2010–2021 | 8 233 307 | 21 de 21 | . | . | 55 919 | 7 de 21 | 13 807 | 18 de 21 | 117 890 | 18 de 21 | 93 792 | 16 de 21 | |
| Oceanía | 1990–2009 | 82 070 | 11 de 18 | . | . | . | . | 102 | 2 de 18 | 664 | 2 de 18 | 599 | 2 de 18 |
| 2010–2021 | 30 422 | 11 de 18 | . | . | 2212 | 1 de 18 | 255 | 2 de 18 | 5092 | 2 de 18 | 3237 | 1 de 18 | |
| Asia del Sur | 1990–2009 | 14 574 240 | 5 de 5 | 22 834 | 3 de 5 | 276 726 | 4 de 5 | 360 479 | 4 de 5 | 4 972 848 | 5 de 5 | 4 541 180 | 5 de 5 |
| 2010–2021 | 2 238 041 | 5 de 5 | . | . | 52 332 | 2 de 5 | 113 838 | 4 de 5 | 1 122 319 | 4 de 5 | 971 269 | 3 de 5 | |
| Sudeste asiático | 1990–2009 | 16 095 170 | 13 de 13 | 89 276 | 1 de 13 | 662 017 | 8 de 13 | 364 423 | 8 de 13 | 3 471 130 | 9 de 13 | 2 478 300 | 9 de 13 |
| 2010–2021 | 10 140 950 | 13 de 13 | . | . | 45 912 | 7 de 13 | 20 488 | 8 de 13 | 44 819 274 | 10 de 13 | 44 534 172 | 8 de 13 | |
| Sur de América Latina | 1990–2009 | 11 202 740 | 3 de 3 | . | . | 195 396 | 2 de 3 | 28 813 | 2 de 3 | 315 381 | 3 de 3 | 101 458 | 3 de 3 |
| 2010–2021 | 4 101 015 | 3 de 3 | . | . | 464 675 | 2 de 3 | 187 474 | 2 de 3 | 1 610 206 | 3 de 3 | 1 496 431 | 3 de 3 | |
| África subsahariana meridional | 1990–2009 | 6 899 016 | 6 de 6 | 3 078 169 | 1 de 6 | 66 048 | 2 de 6 | 12 458 | 4 de 6 | 371 099 | 4 de 6 | 39 088 | 4 de 6 |
| 2010–2021 | 3 905 966 | 6 de 6 | 2 058 541 | 1 de 6 | 262 203 | 2 de 6 | 198 205 | 6 de 6 | 789 849 | 6 de 6 | 535 563 | 6 de 6 | |
| América Latina tropical | 1990–2009 | 27 322 900 | 2 de 2 | 18 530 993 | 1 de 2 | 238 892 | 1 de 2 | 369 451 | 2 de 2 | 264 189 | 2 de 2 | 339 079 | 2 de 2 |
| 2010–2021 | 12 692 420 | 2 de 2 | 9 211 493 | 1 de 2 | 46 175 | 1 de 2 | 101 524 | 1 de 2 | 86 099 | 2 de 2 | 30 973 | 2 de 2 | |
| Europa occidental | 1990–2009 | 114 548 600 | 24 de 24 | 5 166 236 | 2 de 24 | 1 716 285 | 19 de 24 | 1 491 426 | 21 de 24 | 4 367 966 | 20 de 24 | 4 728 278 | 22 de 24 |
| 2010–2021 | 36 034 880 | 24 de 24 | 9 610 507 | 2 de 24 | 8 303 874 | 19 de 24 | 6 104 507 | 20 de 24 | 41 382 029 | 21 de 24 | 43 421 657 | 21 de 24 | |
| África subsahariana occidental | 1990–2009 | 115 334 | 19 de 19 | . | . | 3605 | 2 de 19 | 11 950 | 10 de 19 | 138 332 | 14 de 19 | 74 493 | 9 de 19 |
| 2010–2021 | 29 247 | 19 de 19 | 409 | 2 de 19 | 76 886 | 6 de 19 | 6551 | 13 de 19 | 282 917 | 15 de 19 | 269 633 | 14 de 19 | |
| Total | 1990–2021 | 701 762 090 | 195 de 204 | 149 002 363 | 23 de 204 | 50 864 030 | 104 de 204 | 24 251 653 | 142 de 204 | 322 576 481 | 161 de 204 | 296 231 257 | 154 de 204 |
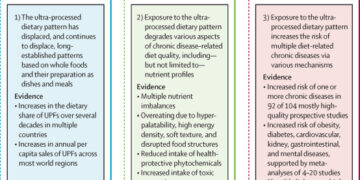
Sepsis y síndromes infecciosos (pasos 1 y 2)
Tasas de letalidad y distribución de patógenos en casos de muerte y casos incidentes (pasos 3 y 4)
Prevalencia de resistencia por patógeno (pasos 5 a 7)
Riesgo relativo de muerte por infección resistente a los medicamentos en comparación con infecciones sensibles a los medicamentos (pasos 8 y 9)
Cálculo de la carga atribuible a la resistencia a los medicamentos y la carga asociada a las infecciones resistentes a los medicamentos (paso 10)
Descomposición de los factores que contribuyen al cambio en las muertes asociadas a la RAM
Previsiones de AMR
Pronóstico de fracciones atribuibles a la población de RAM
Cálculo de la carga futura atribuible y asociada
Desarrollo de escenarios de RAM
Análisis de incertidumbre y validación fuera de muestra
Papel de la fuente de financiación
Resultados
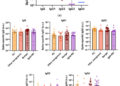
Carga de RAM en 1990-2021
| Número de muertes asociadas (miles) | Tasas de mortalidad asociadas por 100 000 | Número de muertes atribuibles (miles) | Tasa de mortalidad atribuible por 100 000 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1990 | 2019 | 2021 | 2050 | 1990 | 2019 | 2021 | 2050 | 1990 | 2019 | 2021 | 2050 | 1990 | 2019 | 2021 | 2050 | |
| Global | 4780 (4000–5550) | 4940 (4430–5450) | 4710 (4230–5190) | 8220 (6850–9650) | 89,6 (75,0–104) | 63,8 (57,2–70,4) | 59,7 (53,6–65,7) | 87,7 (73,2–104) | 1060 (841–1270) | 1200 (1050–1350) | 1140 (1000–1280) | 1910 (1560–2260) | 19,8 (15,8–23,9) | 15,5 (13,6–17,4) | 14,5 (12,7–16,2) | 20,4 (16,6–24,2) |
| Europa central, Europa del Este y Asia central | 285 (240–330) | 281 (252–310) | 265 (235–295) | 360 (297–420) | 67,8 (57,1–78,4) | 67,1 (60,1–74,0) | 63,4 (56,2–70,6) | 90,5 (76,3–106) | 63,0 (49,5–76,6) | 68,6 (59,2–78,0) | 64,0 (55,2–72,8) | 82,9 (67,1–98,7) | 15,0 (11,8–18,2) | 16·4 (14·1–18·6) | 15·3 (13·2–17·4) | 20,8 (17,0–24,8) |
| Altos ingresos | 477 (385–568) | 579 (513–644) | 553 (489–618) | 883 (674–1040) | 52,5 (42,4–62,5) | 53,3 (47,3–59,3) | 50,7 (44,8–56,6) | 78,1 (59,8–92,2) | 108 (82,9–133) | 131 (115–146) | 125 (110–140) | 192 (146–225) | 11·9 (9·12–14·7) | 12,0 (10,6–13,5) | 11·4 (10·1–12·8) | 17,0 (12,9–19,9) |
| América Latina y el Caribe | 247 (210–284) | 339 (305–372) | 322 (285–360) | 650 (520–808) | 63,3 (53,8–72,8) | 57,9 (52,2–63,6) | 54,2 (47,9–60,6) | 96,7 (78,0–119) | 55,7 (44,4–67,0) | 82,4 (72,4–92,5) | 78,1 (67,7–88,6) | 148 (117–185) | 14·3 (11·4–17·2) | 14·1 (12·4–15·8) | 13·2 (11·4–14·9) | 22·1 (17·5–27·2) |
| África del Norte y Oriente Medio | 264 (219–310) | 243 (211–274) | 226 (194–259) | 525 (430–641) | 78,0 (64,5–91,4) | 40,0 (34,8–45,2) | 36,3 (31,1–41,5) | 61,4 (49,2–73,9) | 63,0 (49,4–76,7) | 64,7 (54,4–75,1) | 60,2 (50,1–70,3) | 133 (107–161) | 18,6 (14,6–22,6) | 10,7 (8,97–12,4) | 9·66 (8·05–11·3) | 15,5 (12,3–19,0) |
| Asia del Sur | 1400 (1170–1630) | 1350 (1200–1500) | 1260 (1110–1420) | 2400 (1910–2980) | 128 (107–149) | 74,7 (66,5–83,0) | 68,5 (60,2–76,8) | 114 (91,3–141) | 308 (249–367) | 356 (303–408) | 335 (282–387) | 604 (463–743) | 28,2 (22,8–33,6) | 19·7 (16·8–22·6) | 18,1 (15,3–21,0) | 28,8 (22,5–35,6) |
| Sudeste asiático, Asia oriental y Oceanía | 1110 (916–1310) | 1140 (995–1290) | 1150 (1010–1290) | 1940 (1580–2370) | 65,8 (54,2–77,5) | 52,8 (46,0–59,5) | 52,7 (46,3–59,1) | 92,0 (75,0–113) | 250 (195–304) | 271 (235–307) | 270 (237–304) | 428 (348–511) | 14,8 (11,5–18,0) | 12,5 (10,9–14,2) | 12,4 (10,8–13,9) | 20,3 (16,4–24,5) |
| África subsahariana | 990 (797–1180) | 1010 (811–1200) | 923 (732–1110) | 1470 (1140–1860) | 202 (162–241) | 93,2 (75,1–111) | 81,5 (64,6–98,4) | 69,3 (53,7–87,5) | 210 (158–262) | 227 (179–276) | 209 (161–257) | 323 (245–416) | 42,8 (32,2–53,3) | 21,0 (16,5–25,5) | 18,5 (14,2–22,7) | 15·3 (11·5–19·5) |
| Recuentos de AVAD asociados (miles) | Tasas de AVAD asociadas por 100 000 | Recuentos de AVAD atribuibles (miles) | Tasas de AVAD atribuibles por cada 100 000 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1990 | 2019 | 2021 | 2050 | 1990 | 2019 | 2021 | 2050 | 1990 | 2019 | 2021 | 2050 | 1990 | 2019 | 2021 | 2050 | |
| Global | 281 000 (232 000–331 000) | 196 000 (170 000–221 000) | 178 000 (154 000–202 000) | 201 000 (165 000–245 000) | 5270 (4350–6200) | 2530 (2190–2860) | 2250 (1950–2550) | 2140 (1750–2630) | 60900 (47700–74100) | 46 800 (39 800–53 700) | 42 600 (36 100–49 000) | 46 500 (37 700–57 300) | 1140 (895–1390) | 604 (514–693) | 539 (458–621) | 496 (399–613) |
| Europa central, Europa del Este y Asia central | 10500 (8770–12100) | 7840 (7010–8670) | 7190 (6380–8000) | 7310 (6010–8680) | 2480 (2080–2880) | 1870 (1670–2070) | 1720 (1530–1920) | 1840 (1530–2180) | 2310 (1790–2840) | 1940 (1650–2230) | 1760 (1500–2030) | 1700 (1380–2060) | 550 (426–674) | 464 (394–533) | 422 (359–485) | 428 (348–516) |
| Altos ingresos | 11 100 (9090–131 00) | 11 700 (10 700–12 700) | 11 200 (10 200–12 200) | 12 800 (10 500–14 600) | 1220 (1000–1450) | 1080 (988–1170) | 1030 (937–1120) | 1130 (931–1290) | 2560 (1970–3140) | 2700 (2450–2960) | 2590 (2340–2830) | 2810 (2280–3220) | 281 (217–345) | 249 (225–273) | 237 (214–260) | 248 (203–285) |
| América Latina y el Caribe | 13 700 (11 500–15 900) | 10 400 (9260–11 400) | 9600 (8420–10 800) | 12 600 (10 200–15 600) | 3510 (2960–4070) | 1770 (1580–1950) | 1620 (1420–1810) | 1880 (1530–2300) | 3030 (2390–3670) | 2540 (2220–2860) | 2350 (2030–2680) | 2910 (2330–3620) | 776 (612–940) | 434 (380–488) | 396 (341–451) | 433 (347–537) |
| África del Norte y Oriente Medio | 17 600 (14 300–20 900) | 10 100 (8470–11 600) | 8770 (7350–10 200) | 13 100 (10 400–16 700) | 5190 (4210–6170) | 1660 (1400–1920) | 1410 (1180–1640) | 1530 (1210–1930) | 4140 (3190–5090) | 2670 (2180–3160) | 2330 (1900–2760) | 3330 (2590–4280) | 1220 (940–1500) | 441 (360–522) | 374 (305–443) | 390 (303–493) |
| Asia del Sur | 96 400 (79 300–113 000) | 59 200 (51 200–67 100) | 52 200 (44 900–59 400) | 57 700 (44 900–72 400) | 8810 (7250–10 400) | 3270 (2840–3710) | 2830 (2430–3220) | 2750 (2170–3500) | 20 800 (16 500–25 000) | 15 000 (12 600–17 300) | 13 300 (11 100–15 500) | 14 400 (10 900–18 200) | 1900 (1510–2290) | 828 (696–959) | 721 (602–839) | 687 (527–881) |
| Sudeste asiático, Asia oriental y Oceanía | 58 500 (47 300–69 700) | 32 400 (28 700–36 000) | 31 400 (28 000–34 800) | 35 200 (29 300–42 800) | 3460 (2800–4120) | 1500 (1330–1670) | 1440 (1280–1590) | 1670 (1410–2020) | 12700 (9750–15600) | 7710 (6760–8660) | 7430 (6560–8300) | 7870 (6580–9480) | 751 (577–924) | 356 (312–400) | 340 (300–380) | 374 (311–453) |
| África subsahariana | 73 400 (58 000–88 900) | 64 100 (49 900–78 300) | 57 300 (43 400–71 200) | 62 100 (43 100–86 000) | 14 900 (11 800–18 100) | 5940 (4620–7260) | 5060 (3830–6280) | 2930 (2100–4160) | 15400 (11400–19400) | 14200 (10900–17600) | 12800 (9450–16100) | 13500 (9210–18800) | 3140 (2320–3950) | 1320 (1010–1630) | 1130 (834–1420) | 637 (448–899) |
| Número de muertes asociadas a la RAM | ||
|---|---|---|
| Muertes asociadas a la RAM, 1990 | 4 770 000 | |
| Factores que influyeron en los cambios en las muertes por RAM entre 1990 y 2019 | ||
| Crecimiento poblacional | +1 740 000 | |
| Estructura por edad | +792 000 | |
| Tasa de mortalidad por sepsis | −3 090 000 | |
| Proporción de muertes por sepsis asociadas con síndromes de RAM | −181 000 | |
| Proporción de muertes por síndrome AMR asociadas con bacterias AMR | +227 000 | |
| Proporción de muertes por bacterias RAM asociadas con resistencia | +675 000 | |
| Cambio neto | 163 000 | |
| Muertes asociadas a la RAM, 2019 | 4 940 000 | |
01867-1/asset/30302617-b85b-4a01-a983-181b6816e3f3/main.assets/gr2.jpg)
01867-1/asset/b2346137-9023-4de0-b829-89591446edf7/main.assets/gr3a.jpg)
01867-1/asset/7ab67c99-1710-492b-8b77-c8fe17537013/main.assets/gr3b.jpg)
01867-1/asset/080946dd-ed7d-4555-9260-b42f7e4236d6/main.assets/gr4.jpg)
Previsiones de carga de RAM
01867-1/asset/a1f132b6-ea8e-46cd-9f83-7f1f23c7df44/main.assets/gr7.jpg)
Impacto de los escenarios
01867-1/asset/a707b6c2-ad56-4506-a5a5-645a89f3a198/main.assets/gr8.jpg)
Discusión
Colaboradores de GBD 2021 en Resistencia a los Antimicrobianos
Afiliaciones
Colaboradores
Intercambio de datos
Declaración de intereses
Expresiones de gratitud
Materiales complementarios (3)
Referencias
Revista sobre resistencia a los antimicrobianos, Londres, 2016
PLoS Med. 2016; 13 , e1002184
Lancet Infect Dis. 2023; 23 :706-718
Revista sobre resistencia a los antimicrobianos, Londres, 2014
Lancet. 2022; 399 :629-655
Lancet. 2022; 400 :2221-2248
Organización Mundial de la Salud, Ginebra, 2024
Lancet Infect Dis. 2019; 19 : 56-66
Lancet. 2020; 395 :200-211
Lancet. 2024; 403 :1989-2056
Lancet Infect Dis. 2024; 2024 publicado en línea el 15 de abril.
Lancet Infect Dis. 2017; 9 :909-948
Lancet. 2024; 403 :2100-2132
Lancet. 2024; 403 :2057-2099
Res. Antimicrobiana J. Global 2021; 27 :101-111
Lancet. 2024; 403 :2204-2256
Lancet. 2024; 403 :2133-2161
Lancet. 2012; 380 :2063-2066
Revista Antimicrobiana Chemother. 2018; 73 :1737-1749
Lancet Global Health. 2022; 10 :e1715-e1743
Lancet Planet Health. 2021; 5 :e893-e904
Revista Médica Americana. 2016; 315 :801-810
Organización Mundial de la Salud, Ginebra, 2020
Medicina de cuidados críticos. 2001; 29 :1303-1310
N Inglés J Med. 2003; 348 :1546-1554
Revista Médica Americana. 2017; 318 :1241-1249
J Comput Graph Stat. 2021; 30 :544-556
Lancet. 2024; 403 :2162-2203
Organización Mundial de la Salud, Ginebra, 2017
Oficina del Censo de los Estados Unidos, Washington, DC, Informes de población actual de 1993
Estudio Populista de Matemáticas. 1991; 3 :105-125
Lancet. 2016; 388 :e19-e23
Toro Órgano Mundial de la Salud. 2016; 94 :111-121A
Comun. Nacional 2023; 14 , 2666
Lancet. 2024; 403 :2439-2454
Lancet Reg Health, Sudeste Asiático. 2023; 22 , 100291
J Pediatric Infect Dis Soc. 2015; 4 :11-20
Infectología clínica 2015; 61 :1835-1838
J Am Geriatr Soc. 2023; 71 :2052-2081
Res . del Servicio de Salud BMC 2012; 12:89
Práctica Eur J Gen. 2008; 14 :28-32
Organización Mundial de la Salud, Ginebra, 2016
Lancet. 2023; 402 :203-234
Lancet. 2020; 396 :1285-1306
Lancet Salud Pública. 2022; 7 :e897-e913
Revista de Salud Pública de Lancet, 2023; 25 , 100561
Control de infecciones Hospital Epidemiología 2023; 44 :1039-1067
N Inglés J Med. 2019; 380 :638-650
Control de infecciones resistentes a los antimicrobianos. 2017; 6 :113
Clin Infect Dis. 2006; 42 :692-699
Lancet. 2024; 403 :2534-2550
Microbiología Mol. Biol. Rev. 2010; 74 :417-433
Lancet Infect Dis. 2023; 23 :1072-1084
Lancet. 2016; 387 :168-175
Lancet Global Health. 2024; 12 :e201-e216
Cuidados críticos. 2018; 22 :232
Pharmacol Res. 2024; 204 , 107188
eVida. 2024; 13 , e85701
Revista Antimicrobiana Chemother. 2021; 76 :3045-3058
JR Soc Med. 2020; 113 :329-334
Revista Epidemiológica 2022; 443 :53-64
Lancet. 2024; 403 :2551-2564
Infectología clínica 2024; 78 :1429-1433
Lancet. 2024; 403 , 2367
Lancet. 2022; 399 :335
Control de infecciones resistentes a los antimicrobianos. 2021 ; 10:63
Infectar la resistencia a los fármacos. 2022; 15 :3589-3609
J Infect. 2021; 82 :355-362
Vigilancia de la salud pública del JMIR. 2024; 10 , e49185
Infectología clínica 1998; 27 :S100-S106
Futuro Microbiol. 2012; 7 :395-410






01867-1/asset/254630ab-b6d3-4b15-b2f2-5d66d0e02de5/main.assets/gr1.jpg)
01867-1/asset/5cb77ce4-94d7-4647-8a3a-3c0ae2f6fbe6/main.assets/gr5.jpg)
01867-1/asset/7edc03b7-518f-40c3-ab75-229ab029bc1e/main.assets/gr6.jpg)