Departamentos de Gastroenterología, Centro Oncológico Miyagi, Natori 981-1293, Miyagi, Japón
Divisiones de Células Madre Cancerosas, Instituto de Investigación del Centro Oncológico Miyagi, Natori 981-1293, Miyagi, Japón
Departamento de Patología, Centro Oncológico Miyagi, Natori 981-1293, Miyagi, Japón
Autor a quien deberá dirigirse la correspondencia.
Cánceres 2025 , 17 (12), 2006; https://doi.org/10.3390/cancers17122006
Presentación recibida: 14 de abril de 2025 / Revisado: 4 de junio de 2025 / Aceptado: 14 de junio de 2025 / Publicado: 16 de junio de 2025
(Este artículo pertenece a la Colección Avances Recientes en Adenocarcinoma Ductal Pancreático )
Resumen simple
Se sabe que la vacunación repetida contra la COVID-19 aumenta la inmunoglobulina G4 (IgG4) específica de la espícula, y existe preocupación sobre su impacto en la inmunidad contra el cáncer. Este estudio tuvo como objetivo investigar la relación entre la vacunación repetida contra la COVID-19 y el pronóstico en pacientes con cáncer de páncreas (CP). Los hallazgos del estudio fueron que las vacunas de refuerzo repetidas contra la COVID-19 se asocian con una menor supervivencia general en pacientes con CP. Cabe destacar que nuestro análisis revela que los altos niveles de IgG4, inducidos por la vacunación, se correlacionan con un pronóstico perjudicial en estos pacientes. Estos hallazgos proporcionan información esencial sobre la interacción entre la vacunación y la progresión del cáncer, lo cual tiene implicaciones significativas para las estrategias de manejo del paciente. Nuestro estudio resalta la necesidad de continuar la investigación sobre los efectos a largo plazo de las vacunas de ARNm en el pronóstico del cáncer, lo cual sigue siendo una preocupación apremiante en el panorama cambiante de la salud pública y el tratamiento del cáncer.
Abstracto
Antecedentes/Objetivos : La vacuna contra la COVID-19 es un avance tecnológico significativo con un uso global generalizado. Sin embargo, su efecto sobre la inmunidad contra el cáncer, particularmente con vacunaciones repetidas, sigue siendo incierto. Nuestro objetivo fue investigar la relación entre las vacunaciones repetidas y el pronóstico del cáncer de páncreas (CP). Además, examinamos los niveles séricos de IgG4, conocido por ser un inmunosupresor que aumenta con las vacunaciones repetidas. Métodos : Examinamos retrospectivamente el efecto de la vacunación sobre la supervivencia en 272 pacientes con CP diagnosticados en nuestro hospital de enero de 2018 a noviembre de 2023 y analizamos los factores pronósticos, incluidos los niveles de IgG4 en 96 pacientes con CP. Se realizó inmunohistoquímica para Foxp3 en el tejido tumoral y se midió el nivel sérico de IgG4. Se recolectaron muestras de suero de 79 pacientes con enfermedades benignas y malignas, incluido el CP, entre septiembre y noviembre de 2023, y se determinó el nivel de IgG4 específico de la espiga mediante un ensayo inmunoabsorbente ligado a enzimas. Resultados : La supervivencia global (SG) de los pacientes con CP se redujo en aquellos vacunados tres veces o más, y los niveles séricos totales de IgG4 aumentaron con el número de vacunaciones. Cabe destacar que la SG fue significativamente menor en el grupo con niveles altos de IgG4, y aumentaron las células Foxp3-positivas en los tejidos tumorales. Las vacunaciones repetidas aumentaron los niveles de IgG4 específica de la espiga, y se observó una correlación positiva entre la IgG4 específica de la espiga y la IgG4 total. Conclusiones : Estos hallazgos resaltan la vacunación repetida como un factor de mal pronóstico en pacientes con CP y sugieren que la IgG4 es inducida por la vacunación repetida y puede estar asociada con un mal pronóstico en estos pacientes.
Palabras clave:
cáncer de páncreas ; vacunación contra la COVID-19 ; vacuna de ARNm ; IgG4 ; inmunidad contra el cáncer
1. Introducción
El cáncer de páncreas (CP) es un cáncer intratable con un mal pronóstico, la tercera causa principal de muertes relacionadas con el cáncer en los Estados Unidos y la cuarta causa principal de muertes relacionadas con el cáncer en Japón [ 1 , 2 ]. En los últimos años, la vigilancia basada en factores de riesgo conocidos (por ejemplo, antecedentes familiares, diabetes mellitus, neoplasia mucinosa papilar intraductal, pancreatitis crónica y obesidad) y la identificación de las características de imagen del CP temprano [ 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 ] han facilitado la detección temprana y un mejor pronóstico [ 15 , 16 , 17 , 18 , 19 ]. La quimioterapia mejorada [ 20 , 21 , 22 ] y la terapia adyuvante en combinación con cirugía también han mejorado los pronósticos [ 23 , 24 , 25 , 26 ].
La infección por coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) comenzó a propagarse en diciembre de 2019 y finalmente se convirtió en una pandemia [ 27 ]. Las vacunas de ARNm contra el SARS-CoV-2 han desempeñado un papel importante en el control de la pandemia de la enfermedad por coronavirus 2019 (COVID-19) [ 28 ]. En Japón, dos vacunas de ARNm, es decir, BNT162b2 (Pfizer-BioNTech, Nueva York, NY, EE. UU.) y ARNm-1273 (Moderna, Cambridge, MA, EE. UU.), fueron aprobadas en febrero y mayo de 2021, respectivamente [ 29 , 30 ]. En diciembre de 2021 se inició una vacunación de refuerzo (tercera dosis de vacunación) para los trabajadores de la salud y en enero de 2022 para la población general. En Japón, el número total de vacunaciones supera los 400 millones, con una tasa de vacunación de dos dosis del 79,8% y una tasa de vacunación de tres dosis del 67,3%, y el número de personas que recibieron más de cuatro dosis supera los 130 millones [ 31 ].
La vacuna de ARNm es un nuevo tipo de vacuna en la que las moléculas de ARNm sintéticas que contienen la secuencia codificante necesaria para construir la proteína de pico del SARS-CoV-2 se encapsulan en nanopartículas lipídicas para permitir la administración del ARNm a las células [ 32 , 33 ], lo que da como resultado la producción de antígenos de pico del SARS-CoV-2 y la posterior inducción de anticuerpos neutralizantes [ 34 ]. Si bien la inmunoglobulina G1 (IgG1) es el factor inmunitario principal y más abundantemente inducido después de la vacunación [ 35 , 36 ], el nivel de IgG4 también aumenta con la vacunación repetida durante un período corto [ 37 ]. La exposición prolongada al mismo antígeno induce un cambio de clase de los linfocitos B para producir IgG4, lo que resulta en una disminución de las funciones efectoras mediadas por el receptor de fragmentos cristalizables (Fc), incluida la fagocitosis celular dependiente de anticuerpos y la citotoxicidad dependiente de anticuerpos contra el cáncer, lo que en última instancia conduce a la evasión inmunitaria del cáncer [ 38 , 39 ]. En el PC, el nivel total de IgG4 sérica está ligeramente elevado (<2 veces) en aproximadamente el 10% de los pacientes, y solo el 1% supera los 280 mg/dL [ 40 ]. Además, un alto grado de infiltración de células plasmáticas IgG4-positivas, como se revela mediante un examen patológico después de la resección, se asocia con un mal pronóstico [ 41 ]. Varios estudios han informado de la asociación de mayores niveles de IgG4 con un mal pronóstico en el colangiocarcinoma intrahepático, el colangiocarcinoma extrahepático, el cáncer gástrico y el cáncer de esófago, pero no en el PC [ 39 , 41 , 42 , 43 , 44 ]. Las células T reguladoras Foxp3-positivas (Treg) también desempeñan un papel importante en la respuesta IgG4 y pueden conducir a un mal pronóstico a través de la evasión inmunitaria del cáncer [ 45 , 46 ].
Por lo tanto, este estudio tuvo como objetivo investigar la relación entre la vacunación con ARNm del SARS-CoV-2 y el pronóstico en pacientes con CP.
2. Materiales y métodos
2.1. Pacientes
Realizamos un análisis retrospectivo en el Departamento de Gastroenterología, Miyagi Cancer Center, donde se enrolaron 272 pacientes con CP entre enero de 2018 y noviembre de 2023 (Cohorte A, Figura 1 ). Entre ellos, la información del historial de vacunación al momento del diagnóstico estaba disponible para 223 pacientes, y se determinaron los niveles totales de IgG e IgG4 (inmunoensayos turbidimétricos y turbidimétricos de látex, respectivamente; BML, Tokio, Japón) en 96 pacientes. De estos 96 pacientes, se realizaron biopsias o resecciones quirúrgicas, así como inmunohistoquímica para Foxp3, en 72 pacientes. Las muestras de los 72 casos comprendían 30 muestras quirúrgicas, 39 muestras de biopsia por aspiración con aguja fina guiada por ecografía endoscópica (EUS-FNA) y 3 muestras de biopsia de los sitios de invasión del duodeno y del conducto biliar, todas las cuales eran CP primario.

Figura 1. Esquema de cohortes en este estudio.
Para medir los anticuerpos específicos de la espiga, se registraron prospectivamente 79 pacientes adicionales [pacientes con PC (n = 16), cáncer distinto de PC (n = 13), enfermedad benigna (n = 32) y enfermedad relacionada con IgG4 (IgG4-RD) (n = 18)] en el Departamento de Gastroenterología, Miyagi Cancer Center, entre septiembre y noviembre de 2023 (Cohorte B, Figura 1 ). Se recogieron muestras de sangre y se midieron los niveles de IgG total, IgG4 total y IgG específica de la espiga. La información sobre el número de vacunas contra la COVID-19 recibidas por los pacientes en el momento de la recogida de la muestra de sangre se obtuvo de los registros médicos. Recopilamos información del tumor sobre el estadio patológico según la clasificación TNM de tumores malignos de la UICC (8.ª edición). Se utilizó la Escala de estado funcional (PS) del Eastern Cooperative Oncology Group para evaluar el estado general del paciente en la visita inicial.
2.2. Inmunohistoquímica
Se realizó inmunohistoquímica para Foxp3 en 72 pacientes de la cohorte A con el sistema Ventana Benchmark (Roche, Basilea, Suiza). El anticuerpo principal utilizado en este estudio fue el anticuerpo anti-Foxp3 (ab20034; Abcam).
2.3. Ensayo inmunoabsorbente ligado a enzimas
Los niveles de IgG específica de la espiga (IgG total, IgG1, IgG2, IgG3 e IgG4) se determinaron utilizando un ensayo inmunoabsorbente ligado a enzimas (ELISA) en la cohorte B, como se describió anteriormente, con ligeras modificaciones [ 47 ]. Brevemente, las placas de 96 pocillos (#9018, Corning, Corning, NY, EE. UU.) se recubrieron durante la noche a 4 °C con proteína de espiga recombinante de longitud completa del SARS-CoV-2 (1 μg/mL en tampón de bicarbonato [pH 9,8], R&D Systems, Minneapolis, MN, EE. UU.). Para la calibración, se recubrieron placas de 96 pocillos durante la noche a 4 °C con IgG1 humana purificada (ab90283, Abcam, Cambridge, Reino Unido, 125 a 8000 ng/mL en tampón de bicarbonato [pH 9,8]), IgG2 (ab90284, Abcam, 62,5 a 4000 ng/mL), IgG3 (ab118426, Abcam, 15,63 a 1000 ng/mL), IgG4 (ab183266, Abcam, 31,25 a 2000 ng/mL) e IgG total (143-09501, Fujifilm Wako, Osaka, Japón, 7,81 a 500 ng/ml). Tras lavar con solución salina tamponada con fosfato que contenía Tween-20 al 0,1 % (PBS-T), las placas se bloquearon con PBS-T que contenía BSA al 1 %. A continuación, se añadieron muestras de suero a las placas en diluciones entre 1:10 y 1:10 000, y se incubaron a 32 °C durante 1 h. Los anticuerpos unidos al antígeno se detectaron con anticuerpos específicos de subclase antihumana de ratón conjugados con HRP (IgG1: 9054-05, IgG2: 9060-05, IgG3: 9210-05, IgG4: 9200-05 e IgG total: 2040-05, Southern Biotech, Birmingham, AL, EE. UU.). La absorbancia se midió a 450 nm con una longitud de onda de referencia de 620 nm utilizando un lector de placas (Synergy LX; Agilent, Santa Clara, CA, EE. UU.).
2.4. Análisis estadístico
Los análisis estadísticos se realizaron utilizando GraphPad Prism (GraphPad Software v10.1.2(324), San Diego, CA, EE. UU.). Se utilizaron pruebas estadísticas no paramétricas, como la prueba de Mann-Whitney para dos grupos y la prueba de Kruskal-Wallis con la prueba de comparaciones múltiples de Dunn para múltiples grupos independientes. Las curvas de supervivencia se generaron utilizando el método de Kaplan-Meier, y la prueba de log-rank o la prueba de Gehan-Breslow-Wilcoxon se utilizó para las pruebas de significancia. Además, se utilizó un método de emparejamiento por puntaje de propensión para reducir los efectos de la confusión. El emparejamiento se realizó utilizando el software R (4.2.2) con un ancho de calibrador igual a 0,2 de la desviación estándar del logaritmo del puntaje de propensión, el método del vecino más cercano y un protocolo de emparejamiento 1:1 sin reemplazo. Las variables se seleccionaron sobre la base de la experiencia clínica y el éxito de equilibrar las distribuciones entre dos grupos. Análisis multivariado de los factores pronósticos, incluyendo la razón neutrófilos-linfocitos (NLR) [ 48 ], escala pronóstica de Glasgow modificada (mGPS) [ 49 ], e índice nutricional pronóstico (PNI) [ 50 ], fueron realizados usando análisis de riesgos proporcionales de Cox. La mGPS y el PNI fueron definidos de acuerdo a informes previos [ 49 , 50 ] de la siguiente manera: nivel de proteína C reactiva (PCR) ≤ 1.0 mg/dL y nivel de Alb ≥ 3.5 g/dL; puntuación 0; nivel de PCR > 1.0 mg/dL o nivel de Alb < 3.5 g/dL; puntuación 1; nivel de PCR > 1.0 mg/dL y nivel de Alb < 3.5 g/dL; puntuación 2. PNI = 10 × Alb (g/dL) + 0,005 × linfocito (/µL)). Los valores de corte para NLR, PNI e IgG4 se determinaron comprobando el área bajo la curva (AUC) con el paquete SurvivalROC en el software R. A continuación, los datos se binarizaron utilizando la tasa de supervivencia prevista a 2 años que mostró la mejor AUC. Determinamos el valor de corte con la menor distancia desde la esquina superior izquierda de la curva ROC dibujada por el paquete pROC ( Figura suplementaria S1 ). Las células Foxp3-positivas en la inmunohistoquímica se observaron en un campo de visión de 40x mayor potencia, y el número de células Foxp3-positivas en el total de células dentro de 0,01 milímetros cuadrados (100 μm × 100 μm) se contó en cinco áreas utilizando el software de visualización de imágenes NDP.view2 (U12388-01, HAMAMATSU). Se realizó un recuento celular total de las células hematoxilina-positivas. Se crearon diagramas de dispersión de IgG4 específica de la espícula e IgG4 total, y se calcularon líneas de regresión y coeficientes de determinación (R² ) mediante el programa R (4.2.2). La significación estadística se estableció en * p < 0,05.
3. Resultados
3.1. La vacunación repetida contra la COVID-19 empeora el pronóstico de los pacientes con CP
Analizamos el pronóstico de los pacientes con CP antes y después de recibir la vacuna contra el SARS-CoV-2 de 2018 a 2023 ( Tabla 1 , Cohorte A). Los resultados de los pacientes habían mejorado cada año hasta 2020; sin embargo, comenzaron a deteriorarse en 2021 ( Figura 2 a). Los resultados en 2022-2023 fueron significativamente peores que los de 2018-2021 ( Figura 2 b). El análisis de riesgos proporcionales de Cox indicó que un historial de recepción de vacunas contra la COVID-19 (tres o más veces) en la visita inicial, PS, ictericia, factores TNM altos, sin cirugía, sin quimioterapia y marcadores tumorales altos, incluido el antígeno carcinoembrionario (CEA) y el antígeno carbohidrato (CA) 19-9, afectaron significativamente la supervivencia general (SG) ( Tabla 2 ). De 272 casos, la información de la vacunación se registró en 223 casos. Al dividir el grupo en dos grupos (0-2 vacunaciones o más de tres), observamos un peor pronóstico en el segundo ( Figura 2 c). Tras el emparejamiento por puntuación de propensión para los factores TNM, la cirugía y la quimioterapia, obtuvimos un resultado similar ( Figura 2 d, Tabla 3 ). Estos datos sugieren que la vacunación repetida es un factor pronóstico negativo.
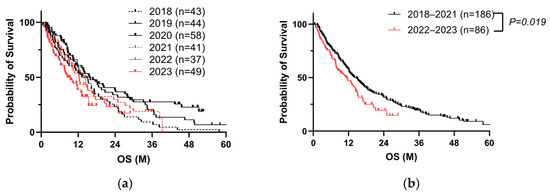
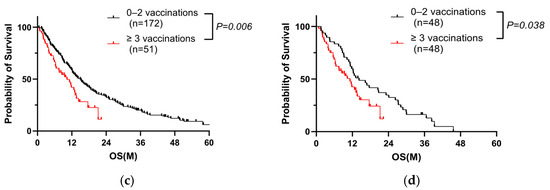
Figura 2. La vacunación repetida contra la COVID-19 se correlaciona con un mal pronóstico del CP. ( a ) Análisis de Kaplan-Meier de 2018 a 2023 en la cohorte A por año. ( b ) Análisis de Kaplan-Meier de 272 pacientes con CP en la cohorte A (prueba de log-rank, p = 0,019, mediana de 11,2 meses frente a mediana de 14,1 meses). ( c ) Análisis de Kaplan-Meier de 223 pacientes con CP con historial de vacunación conocido en la cohorte A (prueba de log-rank, p = 0,006, mediana de 10,3 meses frente a mediana de 14,9 meses). ( d ) Análisis de Kaplan-Meier de 96 pacientes con CP tras el emparejamiento por puntuación de propensión para factores TNM, cirugía y quimioterapia en la cohorte A (prueba de log-rank, p = 0,038, mediana de 11,2 meses frente a mediana de 14,2 meses).
Tabla 1. Características de los pacientes con CP en la cohorte A (n = 272).

Tabla 2. Análisis de riesgos proporcionales de Cox de los factores que afectan el pronóstico del CP (n = 272).

Tabla 3. Características de 223 pacientes con CP con información sobre antecedentes de vacunación en la cohorte A.

3.2. Un nivel elevado de IgG4 total se correlaciona con un mal pronóstico del cáncer de próstata.
Planteamos la hipótesis de que la IgG4, que se sabe que es inducida por la vacunación contra la COVID-19, deteriora el pronóstico de los pacientes con CP. Por lo tanto, comparamos la relación entre los niveles de IgG4 y la vacunación. De 223 casos, el valor sérico de IgG4 se registró en 96 pacientes con información sobre el historial de vacunación ( Tabla 3 ). En esta población, el grupo de tres o más vacunaciones también tuvo un peor pronóstico ( Figura 3 a), similar a la Figura 2 c. Las características de los 96 pacientes con CP de la cohorte A se muestran en la Tabla 4 . El grupo con tres o más vacunaciones tuvo un NLR significativamente mayor y un PNI menor, que también se extrajeron como factores significativos en el análisis multivariado ( Tabla complementaria S1 ). Se obtuvo el mismo resultado cuando se examinaron 66 pacientes con antecedentes coincidentes, excluyendo los casos quirúrgicos ( Figura complementaria S2, Tablas S2 y S3 ). Los niveles totales de IgG4 fueron significativamente más altos en el grupo de tres o más vacunaciones ( Figura 3 b, Tabla 4 ), particularmente para cinco o más vacunaciones ( Figura Suplementaria S3 ). Cuando los pacientes se dividieron en dos grupos según la expresión total de IgG4 ( Tabla Suplementaria S4 ), el pronóstico fue significativamente peor en el grupo con IgG4 alta ( Figura 3 c). Cuando los pacientes se dividieron en dos grupos según la SG, el nivel total de IgG4 también fue significativamente más alto en el grupo de SG corta (<90 días) ( Figura Suplementaria S4 ).
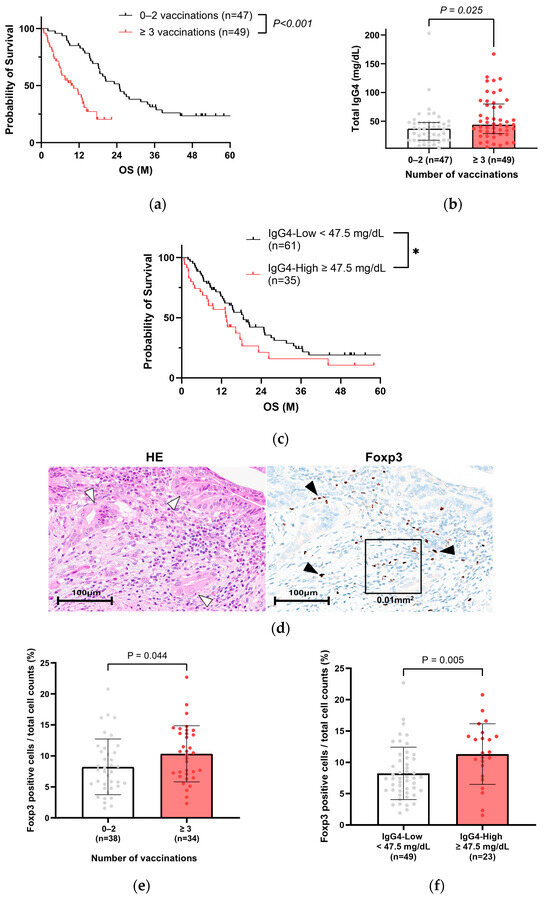
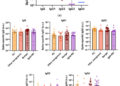
Figura 3. La IgG4 es un factor pronóstico negativo en pacientes con CP. ( a ) Análisis de Kaplan-Meier de 96 pacientes con CP con historial de vacunación conocido y niveles medidos de IgG4 en la cohorte A (prueba de log-rank, p < 0,001, mediana de 10,3 meses frente a mediana de 20,8 meses). ( b ) Comparación de los niveles totales de IgG4 según el número de vacunaciones en 96 pacientes con CP de la cohorte A (prueba de Mann-Whitney, p = 0,025, ≥3 vacunaciones frente a 0-2 vacunaciones). ( c ) Análisis de Kaplan–Meier en pacientes con CP con prueba de IgG4 en la cohorte A (*prueba de log-rank, p = 0,076 y prueba de Gehan-Breslow-Wilcoxon, p = 0,042, grupo con IgG4 alto frente a grupo con IgG4 bajo, el valor de corte para IgG4 es 47,5 mg/dL). ( d ) Imágenes representativas de tejidos de CP (puntas de flecha blancas: células tumorales) con linfocitos Foxp3-positivos (flechas negras). Se utilizó un marco cuadrado (100 µm × 100 µm) para medir el número de células Foxp3-positivas/recuento celular total. ( e ) Comparación de células Foxp3-positivas/recuento celular total por número de vacunaciones (prueba de Mann–Whitney, p = 0,044, ≥3 vacunaciones frente a 0–2 vacunaciones). ( f ) Comparación de los recuentos de células positivas para Foxp3/células totales entre los grupos con niveles altos y bajos de IgG4 sérica (prueba de Mann-Whitney, p = 0,005, el valor de corte para IgG4 es 47,5 mg/dL). PC, cáncer de páncreas.
Tabla 4. Características de los pacientes con CP en la cohorte A (n = 96).

Para investigar las relaciones entre IgG4 y Tregs en pacientes que han sido vacunados repetidamente, se realizó un análisis inmunohistoquímico de Foxp3 en 72 de 96 casos que se habían sometido a resección quirúrgica o biopsia endoscópica ( Tabla suplementaria S5 ). Se observaron células Foxp3-positivas alrededor de las células tumorales ( Figura 3 d). El porcentaje promedio de células Foxp3-positivas en los recuentos celulares totales fue una mediana de 8,3 ± 4,6% en 72 casos, y el porcentaje de células Foxp3-positivas identificadas en o alrededor de las células tumorales fue significativamente mayor en el grupo de tres o más vacunaciones ( Figura 3 e) y en el grupo con altos niveles séricos de IgG4 ( Figura 3 f).
3.3. La IgG4 total, junto con la IgG4 específica de la espícula, aumenta en pacientes con vacunación repetida contra la COVID-19.
Para confirmar que el aumento en el nivel total de IgG4 se debía a la IgG4 específica de la espiga, determinamos las IgG totales y específicas de la espiga en la cohorte B. Las características de 79 pacientes de la cohorte B se muestran en la tabla complementaria S4 . Incluimos enfermedades malignas y benignas distintas del CP para determinar si los cambios en las IgG dependen de enfermedades específicas. Se detectaron IgG1 e IgG4 específicas de la espiga en cantidades mayores, mientras que IgG2 e IgG3 se detectaron en cantidades menores ( Figura 4 a). No se observó ninguna diferencia significativa en los niveles de IgG específica de la espiga, incluida la IgG4, entre los tipos de enfermedad ( Figura 4 b). Los niveles de IgG4, IgG1 e IgG específicas de la espiga aumentaron en los grupos que se vacunaron más de tres veces ( Figura 4 c). Los niveles de IgG4 total e IgG4 específica de la espiga se correlacionaron positivamente en ambos casos ( Figura 4 d) y en los pacientes con CP ( Figura 4 e). El grupo con niveles altos de IgG4 específicos de la espiga tiende a tener un peor pronóstico que el grupo con niveles bajos de IgG4 específicos de la espiga en los casos de CP, aunque la diferencia no es significativa debido a las muestras pequeñas (n = 16) ( Figura suplementaria S5 ).
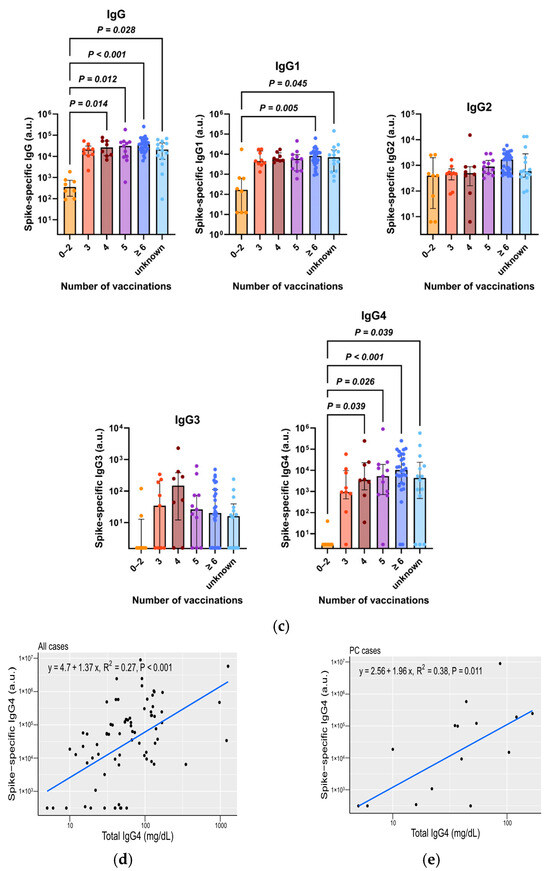
Figura 4. La IgG4 total, junto con la IgG4 específica de la espiga, aumenta en pacientes con vacunación repetida contra la COVID-19. ( a ) Medición de las IgG específicas de la espiga en la cohorte B mediante ELISA. ( b ) Comparación de los valores de IgG específicas de la espiga entre los tipos de enfermedades. No hubo diferencias significativas en los niveles de IgG específicas de la espiga entre los tipos de enfermedad. ( c ) Comparación de los valores de IgG específicas de la espiga según el número de vacunaciones. Los niveles de IgG específica de la espiga, IgG1 e IgG4 aumentaron en los grupos que se vacunaron más de tres veces (prueba de Kruskal-Wallis, p < 0,05, frente a 0-2 vacunaciones). ( d , e ) Gráfico de correlación de la IgG4 total y la IgG4 específica de la espiga en todos los casos (R 2 = 0,27, p < 0,001) ( d ) y casos de PC (R 2 = 0,38, p = 0,011). ( e ) ELISA, ensayo inmunoabsorbente ligado a enzimas; PC, cáncer de páncreas.
4. Discusión
En Japón, la vacuna contra la COVID-19 de tipo ARNm se utiliza principalmente para la inmunización inicial, y se administran inmunizaciones adicionales repetidamente para prevenir enfermedades graves [ 31 ]. Sin embargo, la inmunización repetida con la vacuna contra la COVID-19 puede acelerar la transición a IgG4 [ 51 ] y aumentar los niveles de IgG4 específicos de la espiga [ 37 , 38 , 51 ], lo que es consistente con nuestros hallazgos. Los niveles elevados de IgG4 pueden promover el crecimiento del cáncer al suprimir la inmunidad contra el cáncer y se asocian con un mal pronóstico [ 39 , 41 , 42 , 43 , 44 ]. Solo unos pocos países administran más de cinco dosis de vacunas, y el impacto de las vacunaciones repetidas en los niveles de IgG4 contra el cáncer no está claro. En este estudio, nuestros resultados demostraron que más de tres dosis de vacunación se correlacionaron con un mal pronóstico en pacientes con CP, particularmente en aquellos en quienes el nivel total de IgG4 aumentó después de la vacunación. Un nivel elevado de IgG4 total también se correlacionó con un pronóstico desfavorable. La prueba de Gehan-Breslow-Wilcoxon mostró una marcada diferencia y tiene un impacto particularmente significativo en la mortalidad temprana. La IgG4 se elevó en pacientes con una evolución temprana de 90 días o menos. Se observó una correlación positiva general entre los niveles de IgG4 total y los de IgG4 específica de la espiga. Nuestros hallazgos, en conjunto, indican que la IgG4 específica de la espiga podría correlacionarse con el pronóstico de los pacientes con CP. Hasta donde sabemos, este es el primer estudio que informa una correlación entre la vacunación contra el SARS-CoV-2 y el pronóstico del CP.
En este estudio, un NLR y mGPS1-2 altos, y un PNI bajo, todos ellos índices nutricionales e indicadores de un mal pronóstico en el CP [ 48 , 49 , 50 , 52 ], se correlacionaron significativamente con un mal pronóstico. El análisis multivariado reveló que la vacunación repetida, pero no el NLR, mGPS y PNI, fue un factor independiente de mal pronóstico, lo que sugiere que los índices nutricionales son factores de confusión. De hecho, la vacunación repetida se correlacionó significativamente con el NLR y el PNI. Un informe previo también demostró que la vacunación aumenta el NLR [ 53 ]. Estos datos sugieren que la vacunación influye en los neutrófilos y los linfocitos. Estudios adicionales deberían dilucidar si las vacunas alteran los subconjuntos de leucocitos, lo que resulta en un aumento en la producción de IgG4.
La vacunación también altera otros componentes del sistema inmunitario, además de IgG4, y se han informado posibles efectos secundarios en estudios preclínicos previos. Seneff et al. informaron que la vacunación suprime la señalización del interferón tipo I y tiene varios efectos adversos sobre la salud humana, incluida la vigilancia del cáncer [ 54 ]. La vacunación con BNT162b2 provocó un aumento de Tregs [ 55 , 56 ]. Los Tregs, un subconjunto de células T CD4+ que expresan Foxp3, desempeñan un papel fundamental en la supresión de las respuestas inmunitarias y la migración hacia los tumores en presencia de quimiocinas para suprimir las respuestas inmunitarias antitumorales, lo que provoca que las células cancerosas crezcan y proliferen [ 57 ]. Una alta infiltración de Tregs se ha asociado con una baja supervivencia en varios tipos de cáncer [ 58 ]. En ratones, el porcentaje de Tregs CD25+Foxp3+CD4+ y los niveles de citocinas de inmunosupresión IL-10 aumentaron tras la vacunación de refuerzo prolongada con la vacuna RBD. Esto puede resultar en la reducción de la activación y diferenciación de las células B en la estimulación con antígenos, inhibición funcional de las células presentadoras de antígenos, una disminución consecuente en la activación de las células T CD8+ y un aumento de la expresión de PD-1 y LAG-3 en estas células T [ 59 ]. La exposición repetida a antígenos conduce al agotamiento de las células T [ 60 , 61 , 62 ]. En conjunto, la vacunación repetida con el refuerzo de la vacuna de ARNm de COVID-19 puede ser un riesgo potencial de cáncer. Algunos estudios han informado de la asociación entre la espiga de SARS-CoV-2 y p53 [ 63 , 64 ]. Este estudio también mostró una correlación significativa entre los niveles séricos de IgG4 y la infiltración de células Foxp3-positivas en los tejidos, lo que sugiere que Treg podría ser un factor para un mal pronóstico en pacientes vacunados repetidamente. Se necesitan más estudios para determinar la vía detallada a través de la cual las vacunaciones repetidas afectan el pronóstico.
Estudios previos indican que el número de células plasmáticas IgG4-positivas en los tejidos aumenta en IgG4-RD, con niveles elevados de IgG4 sérica total [ 65 , 66 ]. La mayor infiltración de células plasmáticas IgG4-positivas en o alrededor de los tejidos cancerosos se ha asociado con un mal pronóstico en cánceres que incluyen PC , colangiocarcinoma, cáncer gástrico y cáncer de esófago [ 39 , 41 , 42 , 43 , 44 ]. La infiltración intratumoral de alto nivel de células plasmáticas IgG4-positivas es un predictor independiente de mala SG en pacientes con PC después de la resección curativa, y los macrófagos asociados al tumor polarizados M2 dentro del tumor se asocian con la inducción de IgG4 [ 41 ]. En el carcinoma colangiocelular, también se ha informado de la participación de Treg e IL-10 en la inducción de IgG4 [ 43 ]. Además, los niveles elevados de IgG4 sérica total, independientemente de la especificidad del antígeno, pueden afectar el microambiente del cáncer [ 39 ]. La vacunación repetida con ARNm de la COVID-19 da como resultado un cambio de clase de IgG4 y una disminución de la activación de las células NK por anticuerpos específicos de S1 [ 67 , 68 ]. El aumento local de IgG4 en el microambiente del cáncer debería inhibir las respuestas anticancerígenas mediadas por anticuerpos, lo que permite que el cáncer evada un ataque inmunológico local y promueva indirectamente el crecimiento del cáncer; además, los niveles más altos de IgG4 se han asociado con una progresión más agresiva del cáncer [ 39 ]. Sin embargo, se debe tener en cuenta que el efecto de los títulos elevados de IgG4 en la función de Fc puede depender de la interacción entre el anticuerpo y el antígeno [ 68 ]. La identificación de IgG4 específica de la espiga en los tejidos tumorales facilitaría el análisis futuro de la relación entre la vacunación y el pronóstico.
5. Limitaciones
Este estudio fue un estudio de cohorte retrospectivo, de un solo centro, que comprendió 96 casos de PC. Sin embargo, los 79 casos en los que se midió IgG4 anti-spike incluyeron muestras que se recolectaron en aproximadamente 3 meses. El tamaño de la muestra de 96 casos fue pequeño, correspondiente a 96 de 272 pacientes con PC tratados durante el mismo período, y no se midieron todos los casos de PC con IgG4. Por lo tanto, existe la posibilidad de sesgo en la muestra seleccionada para las mediciones de IgG4. Se incluyeron todos los estadios de PC en este estudio. El número de dosis de vacunación considerado en este estudio no tuvo en cuenta las vacunaciones posteriores recibidas después de la recolección de sangre ni los antecedentes de COVID-19. El estudio tampoco consideró posibles factores de confusión como las comorbilidades del paciente, el tratamiento concurrente o el tipo de vacuna. El presente estudio reveló discrepancias entre los resultados de la prueba de Gehan-Breslow-Wilcoxon y los resultados del análisis multivariado con respecto al efecto de IgG4 en el pronóstico de PC. Debido al pequeño tamaño de la muestra, resulta difícil explicar esta discrepancia con precisión. Se requieren más estudios para determinar el impacto de la IgG4 en el pronóstico del CP. Las investigaciones futuras deberían incorporar una cohorte más grande e investigar otros mecanismos implicados en la inmunidad al SARS-CoV-2 tras la vacunación.
6. Conclusiones
La vacunación repetida es un factor de mal pronóstico en pacientes con CP. La vacunación repetida aumentó los niveles séricos totales y específicos de la espícula de IgG4, lo que podría estar asociado con un mal pronóstico.
Materiales suplementarios
La siguiente información complementaria se puede descargar en: https://www.mdpi.com/article/10.3390/cancers17122006/s1 , Figura S1: Los valores de corte para NLR, PNI e IgG4 se determinaron según ROC; Figura S2: Análisis de Kaplan-Meier de 66 pacientes con PC en la cohorte A sin tratamiento quirúrgico (prueba de log-rank, p < 0,001, mediana 7,5 frente a mediana 18,1); Figura S3: IgG4 total medida en pacientes con cáncer de páncreas en la cohorte A; Figura S4: Comparación de los valores séricos de IgG4 entre los grupos de supervivencia global ≥ 90 días y <90 días (prueba de Mann-Whitney, p = 0,033); Figura S5: Análisis de Kaplan-Meier de 16 pacientes con PC divididos en niveles altos y bajos de IgG4 específica de pico en la cohorte B (prueba de log-rank, p = 0,12, mediana indefinida frente a mediana 6,3); Tabla S1: Análisis de riesgos proporcionales de Cox de los factores que afectan al pronóstico de PC (n = 96); Tabla S2: Características de 66 pacientes con PC corregidos por la exclusión de casos quirúrgicos en la cohorte A; Tabla S3: Análisis de riesgos proporcionales de Cox de los factores que afectan al pronóstico de PC (casos no quirúrgicos n = 66); Tabla S4: Características de los grupos de IgG4 alto y bajo en la cohorte A; Tabla S5: Características de 72 pacientes con PC que se sometieron a inmunohistoquímica en la cohorte A; Tabla S6: Características de 79 pacientes en la cohorte B.
Contribuciones del autor
Conceptualización, MA, KO, MM y KT; metodología, MA, KO, MM y KT; análisis formal, MA y KT; investigación, MA, MM, RS-T y KT; recursos, KO, YW, WI, JK, MS, SS e IS; curación de datos, MA; redacción: preparación del borrador original, MA, MM y KT; redacción: revisión y edición, KO, YW, WI, JK, MS, SS e IS; adquisición de financiación, MA y KT Todos los autores han leído y aceptado la versión publicada del manuscrito.
Fondos
Este estudio fue financiado por JSPS KAKENHI (subvención n.° JP: 22K07313, 20K17068) para la investigación del cáncer.
Declaración de la Junta de Revisión Institucional
El estudio se llevó a cabo de conformidad con la Declaración de Helsinki y fue aprobado por el Comité de Ética del Centro Oncológico Miyagi (n.º de aprobación 2023-011; aprobado el 5 de septiembre de 2023, y 2024-003; aprobado el 11 de primavera de 2024). Se obtuvo el consentimiento informado de todos los participantes del estudio a través de un proceso de exclusión voluntaria.
Declaración de consentimiento informado
Se obtuvo el consentimiento informado de todos los sujetos involucrados en el estudio a través de un proceso de exclusión voluntaria.
Declaración de disponibilidad de datos
Todos los datos generados o analizados durante este estudio están incluidos en este artículo publicado y sus archivos de información complementaria .
Expresiones de gratitud
Agradecemos a Yasuda (Instituto de Investigación del Centro Oncológico Miyagi) por sus sugerencias críticas.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
Abreviaturas
En este manuscrito se utilizan las siguientes abreviaturas:
| ordenador personal | Cáncer de páncreas |
| SARS-CoV-2 | Síndrome respiratorio agudo severo coronavirus 2 |
| COVID-19 | Enfermedad del coronavirus 2019 |
| IgG | Inmunoglobulina G |
| PD | Estado de rendimiento |
| CEA | Antígeno carcinoembrionario |
| CA19-9 | Antígeno de carbohidratos 19-9 |
| IgG4-RD | Enfermedad relacionada con IgG4 |
| ELISA | Ensayo inmunoabsorbente ligado a enzimas |
| NLR | Relación neutrófilos-linfocitos |
| mGPS | puntuación pronóstica de Glasgow modificada |
| PNI | Índice nutricional pronóstico |
| PCR | Proteína C reactiva |
| AUC | Área bajo la curva. |
| República de China | Característica de funcionamiento del receptor |
| Sistema operativo | Supervivencia general |
Referencias
- Datos y cifras sobre el cáncer de la Sociedad Estadounidense del Cáncer. 2023. Disponible en línea: https://www.cancer.org/research/cancer-facts-statistics/all-cancer-facts-figures/2023-cancer-facts-figures.html (consultado el 12 de enero de 2024).
- Estadísticas proyectadas de cáncer del Centro Nacional del Cáncer de Japón. 2022. Disponible en línea: https://ganjoho.jp/reg_stat/statistics/stat/short_pred_en.html (consultado el 11 de enero de 2024).
- Abe, K.; Kitago, M.; Kitagawa, Y.; Hirasawa, A. Cáncer de páncreas hereditario. Int. J. Clin. Oncol. 2021 , 26 , 1784-1792. [ Google Académico ] [ CrossRef ]
- Matsubayashi, H.; Takaori, K.; Morizane, C.; Maguchi, H.; Mizuma, M.; Takahashi, H.; Wada, K.; Hosoi, H.; Yachida, S.; Suzuki, M.; et al. Cáncer de páncreas familiar: concepto, tratamiento y problemas. World J. Gastroenterol. 2017 , 23 , 935–948. [ Google Académico ] [ CrossRef ]
- Klein, AP Epidemiología del cáncer de páncreas: Comprensión del papel del estilo de vida y los factores de riesgo hereditarios. Nat. Rev. Gastroenterol. Hepatol. 2021 , 18 , 493–502. [ Google Académico ] [ CrossRef ]
- Hassan, MM; Bondy, ML; Wolff, RA; Abbruzzese, JL; Vauthey, J.-N.; Pisters, P.W.; Evans, DB; Khan, R.; Chou, T.-H.; Lenzi, R.; et al. Factores de riesgo de cáncer de páncreas: Estudio de casos y controles. Am. J. Gastroenterol. 2007 , 102 , 2696–2707. [ Google Académico ] [ CrossRef ]
- Maitra, A.; Sharma, A.; Brand, RE; Van Den Eeden, SK; Fisher, WE; Hart, PA; Hughes, SJ; Mather, KJ; Pandol, SJ; Park, WG; et al. Un estudio prospectivo para establecer una cohorte de diabetes de nueva aparición: del Consorcio para el Estudio de la Pancreatitis Crónica, la Diabetes y el Cáncer de Páncreas. Páncreas 2018 , 47 , 1244–1248. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Tanaka, M.; Fernández-Del Castillo, C.; Kamisawa, T.; Jang, JY; Levy, P.; Ohtsuka, T.; Salvia, R.; Shimizu, Y.; Tada, M.; Wolfgang, CL Revisiones de las directrices del consenso internacional de Fukuoka para el tratamiento de la IPMN del páncreas. Pancreatología 2017 , 17 , 738–753. [ Google Scholar ] [ CrossRef ]
- Vege, SS; Ziring, B.; Jain, R.; Moayyedi, P.; Comité de Guías Clínicas; Asociación Americana de Gastroenterología. Guía del Instituto de la Asociación Americana de Gastroenterología sobre el Diagnóstico y el Tratamiento de Quistes Pancreáticos Neoplásicos Asintomáticos. Gastroenterología 2015 , 148 , 819–822; quize12–13. [ Google Académico ] [ CrossRef ]
- Grupo Europeo de Estudio sobre Tumores Quísticos del Páncreas. Guía Europea Basada en la Evidencia sobre Neoplasias Quísticas Pancreáticas. Gut 2018 , 67 , 789–804. [ Google Académico ] [ CrossRef ]
- Kirkegård, J.; Mortensen, F. V.; Cronin-Fenton, D. Pancreatitis crónica y riesgo de cáncer de páncreas: una revisión sistemática y un metaanálisis. Am. J. Gastroenterol. 2017 , 112 , 1366–1372. [ Google Académico ] [ CrossRef ]
- Gandhi, S.; de la Fuente, J.; Murad, MH; Majumder, S. La pancreatitis crónica es un factor de riesgo de cáncer de páncreas y su incidencia aumenta con la duración de la enfermedad: Revisión sistemática y metaanálisis. Clin. Transl. Gastroenterol. 2022 , 13 , e00463. [ Google Académico ] [ CrossRef ]
- Michaud, DS; Giovannucci, E.; Willett, WC; Colditz, GA; Stampfer, MJ; Fuchs, CS. Actividad física, obesidad, estatura y riesgo de cáncer de páncreas. JAMA 2001 , 286 , 921–929. [ Google Académico ] [ CrossRef ]
- Kanno, A.; Masamune, A.; Hanada, K.; Maguchi, H.; Shimizu, Y.; Ueki, T.; Hasebe, O.; Ohtsuka, T.; Nakamura, M.; Takenaka, M.; et al. Estudio multicéntrico del cáncer de páncreas temprano en Japón. Pancreatología 2018 , 18 , 61–67. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Singhi, AD; Koay, EJ; Chari, ST; Maitra, A. Detección temprana del cáncer de páncreas: oportunidades y desafíos. Gastroenterología 2019 , 156 , 2024-2040. [ Google Académico ] [ CrossRef ]
- Pereira, SP; Oldfield, L.; Ney, A.; Hart, PA; Keane, MG; Pandol, SJ; Li, D.; Greenhalf, W.; Jeon, CY; Koay, EJ; et al. Detección temprana del cáncer de páncreas. Lancet Gastroenterol. Hepatol. 2020 , 5 , 698–710. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Wood, LD; Canto, MI; Jaffee, EM; Simeone, DM. Cáncer de páncreas: patogénesis, detección, diagnóstico y tratamiento. Gastroenterología 2022 , 163 , 386–402.e1. [ Google Académico ] [ CrossRef ]
- Goggins, M.; Overbeek, KA; Brand, R.; Syngal, S.; Del Chiaro, M.; Bartsch, D.K.; Bassi, C.; Carrato, A.; Farrell, J.; Fishman, EK; et al. Manejo de pacientes con mayor riesgo de cáncer de páncreas familiar: Recomendaciones actualizadas del Consorcio Internacional de Detección del Cáncer de Páncreas (CAPS). Gut 2020 , 69 , 7–17. [ Google Académico ] [ CrossRef ]
- Partyka, O.; Pajewska, M.; Kwaśniewska, D.; Czerw, A.; Deptała, A.; Budzik, M.; Cípora, E.; Gąska, I.; Gazdowicz, L.; Mielnik, A.; et al. Descripción general de la epidemiología del cáncer de páncreas en Europa y recomendaciones para la detección en poblaciones de alto riesgo. Cánceres 2023 , 15 , 3634. [ Google Scholar ] [ CrossRef ]
- Conroy, T.; Desseigne, F.; Ychou, M.; Bouche, O.; Guimbaud, R.; Bécouarn, Y.; Adenis, A.; Raoul, J.-L.; Gourgou-Bourgade, S.; De La Fouchardière, C.; et al. FOLFIRINOX versus gemcitabina para el cáncer de páncreas metastásico. N. inglés. J. Med. 2011 , 364 , 1817–1825. [ Google Scholar ] [ CrossRef ]
- Von Hoff, DD; Ervin, T.; Arena, FP; Chiorean, EG; Infante, J.; Moore, M.; Seay, T.; Tjulandin, SA; Ma, WW; Saleh, MN; et al. Aumento de la supervivencia en el cáncer de páncreas con Nab-paclitaxel más gemcitabina. N. Engl. J. Med. 2013 , 369 , 1691–1703. [ Google Académico ] [ CrossRef ]
- Wang-Gillam, A.; Li, C.-P.; Bodoky, G.; Dean, A.; Shan, Y.-S.; Jameson, G.; Macarulla, T.; Lee, K.-H.; Cunningham, D.; Blanc, JF; et al. Irinotecán nanoliposomal con fluorouracilo y ácido folínico en cáncer de páncreas metastásico tras terapia previa con gemcitabina (NAPOLI-1): Un ensayo clínico global, aleatorizado, abierto y de fase 3. Lancet 2016 , 387 , 545–557. [ Google Académico ] [ CrossRef ] [ PubMed ]
- No, M.; Motoi, F.; Matsuyama, Y.; Satoi, S.; Matsumoto, I.; Aosasa, S.; Shirakawa, H.; Wada, K.; Fujii, T.; Yoshitomi, H.; et al. Ensayo aleatorizado de fase II/III de quimioterapia neoadyuvante con gemcitabina y S-1 versus cirugía inicial para el cáncer de páncreas resecable (Prep-02/JSAP-05). Japón. J.Clin. Oncol. 2019 , 37 , 189. [ Google Scholar ] [ CrossRef ]
- Oettle, H.; Neuhaus, P.; Hochhaus, A.; Hartmann, J.T.; Gellert, K.; Ridwelski, K.; Niedergethmann, M.; Zülke, C.; Fahlke, J.; Arning, MB; et al. Quimioterapia adyuvante con gemcitabina y resultados a largo plazo en pacientes con cáncer de páncreas resecado: el ensayo aleatorizado CONKO-001. JAMA 2013 , 310 , 1473–1481. [ Google Académico ] [ CrossRef ]
- Uesaka, K.; Boku, N.; Fukutomi, A.; Okamura, Y.; Konishi, M.; Matsumoto, I.; Kaneoka, Y.; Shimizu, Y.; Nakamori, S.; Sakamoto, H.; et al. Quimioterapia adyuvante de S-1 versus gemcitabina para el cáncer de páncreas resecado: un ensayo de fase 3, abierto, aleatorizado y de no inferioridad (JASPAC 01). Lanceta 2016 , 388 , 248–257. [ Google Scholar ] [ CrossRef ]
- Conroy, T.; Hammel, P.; Hebbar, M.; Ben Abdelghani, M.; Wei, AC; Raoul, J.-L.; Chone, L.; Francois, E.; Artru, P.; Biagi, JJ; et al. FOLFIRINOX o gemcitabina como terapia adyuvante para el cáncer de páncreas. N. inglés. J. Med. 2018 , 379 , 2395–2406. [ Google Scholar ] [ CrossRef ]
- Lu, H.; Stratton, CW; Tang, Y. Brote de neumonía de etiología desconocida en Wuhan, China: El misterio y el milagro. J. Med. Virol. 2020 , 92 , 401–402. [ Google Académico ] [ CrossRef ]
- Altmann, DM; Boyton, RJ Vacunación contra la COVID-19: El camino a seguir. Science 2022 , 375 , 1127–1132. [ Google Académico ] [ CrossRef ]
- polaco, FP; Thomas, SJ; Kitchin, N.; Absalón, J.; Gurtman, A.; Lockhart, S.; Pérez, JL; Pérez Marc, G.; Moreira, ED; Zerbini, C.; et al. Seguridad y eficacia de la vacuna Covid-19 de ARNm BNT162b2. N. inglés. J. Med. 2020 , 383 , 2603–2615. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Baden, LR; El Sahly, HM; Essink, B.; Kotloff, K.; Frey, S.; Novak, R.; Diemert, D.; Spector, SA; Rouphael, N.; Creech, CB; et al. Eficacia y seguridad de la vacuna ARNm-1273 contra el SARS-CoV-2. N. Engl. J. Med. 2021 , 384 , 403–416. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Temas actuales de la Oficina del Primer Ministro de Japón: Vacunas contra la COVID-19. Disponible en línea: https://japan.kantei.go.jp/ongoingtopics/index.html (consultado el 12 de enero de 2024).
- Verbeke, R.; Lentacker, I.; De Smedt, Carolina del Sur; Dewitte, H. El amanecer de las vacunas de ARNm: el caso de la COVID-19. J.Control. Versión 2021 , 333 , 511–520. [ Google Scholar ] [ CrossRef ]
- Teo, SP. Revisión de las vacunas de ARNm contra la COVID-19: BNT162b2 y ARNm-1273. J. Pharm. Pract. 2022 , 35 , 947–951. [ Google Académico ] [ CrossRef ]
- Evans, JP; Zeng, C.; Carlin, C.; Lozanski, G.; Saif, LJ; Oltz, EM; Gumina, RJ; Liu, S.-L. Las respuestas de anticuerpos neutralizantes generadas por la vacunación con ARNm del SARS-CoV-2 disminuyen con el tiempo y se intensifican con la infección posvacunación. Sci. Transl. Med. 2022 , 14 , eabn8057. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chen, W.; Zhang, L.; Li, J.; Bai, S.; Wang, Y.; Zhang, B.; Zheng, Q.; Chen, M.; Zhao, W.; Wu, J. Cinética de las subclases de IgG y su contribución a la actividad neutralizante contra la cepa silvestre y variantes del SARS-CoV-2 en adultos sanos inmunizados con la vacuna inactivada. Inmunología 2022 , 167 , 221–232. [ Google Académico ] [ CrossRef ]
- Vidarsson, G.; Dekkers, G.; Rispens, T. Subclases y alotipos de IgG: De la estructura a las funciones efectoras. Front. Immunol. 2014 , 5 , 520. [ Google Académico ] [ CrossRef ]
- Kiszel, P.; Sík, P.; Miklós, J.; Kajdácsi, E.; Sinkovits, G.; Cervenak, L.; Prohászka, Z. El cambio de clase hacia anticuerpos IgG4 específicos de la proteína Spike después de la vacunación con ARNm del SARS-CoV-2 depende del historial de infecciones previas. Ciencia. Rep. 2023 , 13 , 13166. [ Google Scholar ] [ CrossRef ]
- Irrgang, P.; Gerling, J.; Kocher, K.; Lapuente, D.; Steininger, P.; Habenicht, K.; Wytopil, M.; Beileke, S.; Schäfer, S.; Zhong, J.; et al. Cambio de clase hacia anticuerpos IgG4 no inflamatorios específicos de la espícula tras la vacunación repetida con ARNm del SARS-CoV-2. Sci. Immunol. 2023 , 8 , eade2798. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Wang, H.; Xu, Q.; Zhao, C.; Zhu, Z.; Zhu, X.; Zhou, J.; Zhang, S.; Yang, T.; Zhang, B.; Li, J.; et al. Un mecanismo de evasión inmunitaria con IgG4 que desempeña un papel esencial en el cáncer y sus implicaciones para la inmunoterapia. J. Immunother. Cancer 2020 , 8 , e000661. [ Google Académico ] [ CrossRef ]
- Ghazale, A.; Chari, ST; Smyrk, TC; Levy, MJ; Topazian, MD; Takahashi, N.; Clain, JE; Pearson, RK; Pelaez-Luna, M.; Petersen, BT; et al. Valor de la IgG4 sérica en el diagnóstico de pancreatitis autoinmune y en su distinción del cáncer de páncreas. Am. J. Gastroenterol. 2007 , 102 , 1646–1653. [ Google Académico ] [ CrossRef ]
- Liu, Q.; Niu, Z.; Li, Y.; Wang, M.; Pan, B.; Lu, Z.; Liao, Q.; Zhao, Y. La infiltración de células plasmáticas con inmunoglobulina G4 (IgG4) positiva se asocia con los rasgos clinicopatológicos y el pronóstico del cáncer de páncreas tras la resección curativa. Cancer Immunol. Immunother. 2016 , 65 , 931–940. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Yoshizawa, T.; Uehara, T.; Iwaya, M.; Asaka, S.; Nakajima, T.; Kinugawa, Y.; Shimizu, A.; Kubota, K.; Notake, T.; Masuo, H.; et al. La expresión de IgG4 y la relación IgG4/IgG en el frente de invasión tumoral predicen los resultados a largo plazo en pacientes con colangiocarcinoma intrahepático. Patología 2023 , 55 , 508–513. [ Google Académico ] [ CrossRef ]
- Harada, K.; Shimoda, S.; Kimura, Y.; Sato, Y.; Ikeda, H.; Igarashi, S.; Ren, X.-S.; Sato, H.; Nakanuma, Y. Importancia de las células positivas para inmunoglobulina G4 (IgG4) en el colangiocarcinoma extrahepático: Mecanismo molecular de la reacción de IgG4 en el tejido canceroso. Hepatología 2012 , 56 , 157–164. [ Google Académico ] [ CrossRef ]
- Miyatani, K.; Saito, H.; Murakami, Y.; Watanabe, J.; Kuroda, H.; Matsunaga, T.; Fukumoto, Y.; Osaki, T.; Nakayama, Y.; Umekita, Y.; et al. Una gran cantidad de células IgG4 positivas en el tejido del cáncer gástrico se asocia con la progresión del tumor y un mal pronóstico. Arco de Virchow. 2016 , 468 , 549–557. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Hiraoka, N.; Onozato, K.; Kosuge, T.; Hirohashi, S. La prevalencia de linfocitos T reguladores FOXP3+ aumenta durante la progresión del adenocarcinoma ductal pancreático y sus lesiones premalignas. Clin. Cancer Res. 2006 , 12 , 5423–5434. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Harada, K.; Nakanuma, Y. Colangiocarcinoma con respecto a la reacción de IgG4. Int . J. Hepatol. 2014 , 803876. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Sinkovits, G.; Szilágyi, Á.; Farkas, P.; Inotai, D.; Szilvási, A.; Tordai, A.; Rázsó, K.; Réti, M.; Prohászka, Z. Concentración y distribución de subclases de autoanticuerpos IgG anti-ADAMTS13 en diferentes etapas de la púrpura trombocitopénica trombótica idiopática adquirida. Frente. Inmunol. 2018 , 9 , 1646. [ Google Scholar ] [ CrossRef ]
- Cheng, H.; Long, F.; Jaiswar, M.; Yang, L.; Wang, C.; Zhou, Z. Función pronóstica de la proporción neutrófilos-linfocitos en el cáncer de páncreas: un metaanálisis. Sci. Rep. 2015 , 5 , 11026. [ Google Académico ] [ CrossRef ]
- Imaoka, H.; Mizuno, N.; Hara, K.; Hijioka, S.; Tajika, M.; Tanaka, T.; Ishihara, M.; Yogui, T.; Tsutsumi, H.; Fujiyoshi, T.; et al. Evaluación de la puntuación de pronóstico de Glasgow modificada para el cáncer de páncreas: un estudio de cohorte retrospectivo. Páncreas 2016 , 45 , 211–217. [ Google Scholar ] [ CrossRef ]
- Geng, Y.; Qi, Q.; Sun, M.; Chen, H.; Wang, P.; Chen, Z. El índice nutricional pronóstico predice la supervivencia y se correlaciona con la respuesta inflamatoria sistémica en el cáncer de páncreas avanzado. Eur. J. Surg. Oncol. 2015 , 41 , 1508–1514. [ Google Académico ] [ CrossRef ]
- Uversky, VN; Redwan, EM; Makis, W.; Rubio-Casillas, A. Los anticuerpos IgG4 inducidos por la vacunación repetida podrían generar inmunotolerancia a la proteína Spike del SARS-CoV-2. Vaccines 2023 , 11 , 991. [ Google Scholar ] [ CrossRef ]
- Ahmad, J.; Grimes, N.; Farid, S.; Morris-Stiff, G. Sistemas de puntuación relacionados con la respuesta inflamatoria para evaluar el pronóstico de pacientes con adenocarcinoma ductal pancreático: Una revisión sistemática. Hepatobiliary Pancreat. Dis. Int. 2014 , 13 , 474–481. [ Google Académico ] [ CrossRef ]
- Rafeeq, M.; Jabir, MS; Al-Kuraishy, HM; Jeddoa, ZMA; Jawad, SF; Najm, MaA; Almulla, AF; Elekhnawy, E.; Tayyeb, JZ; Turkistani, A.; et al. Evaluación de los marcadores hematológicos e inmunológicos tras la primera y la segunda dosis de la vacuna de ARNm BNT162b2. Eur. Rev. Med. Pharmacol. Sci. 2024 , 28 , 2605–2614. [ Google Académico ] [ CrossRef ]
- Seneff, S.; Nigh, G.; Kyriakopoulos, AM; McCullough, PA. Inmunosupresión innata por vacunas de ARNm contra el SARS-CoV-2: El papel de los G-cuádruplex, los exosomas y los microARN. Food Chem. Toxicol. 2022 , 164 , 113008. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Arbel, R.; Peretz, A.; Sergienko, R.; Friger, M.; Beckenstein, T.; Duskin-Bitan, H.; Yaron, S.; Hammerman, A.; Bilenko, N.; Netzer, D. Efectividad de una dosis de refuerzo de la vacuna bivalente de ARNm para prevenir la gravedad de la COVID-19: Un estudio de cohorte retrospectivo. Lancet Infect. Dis. 2023 , 23 , 914–921. [ Google Académico ] [ CrossRef ]
- La Gualana, F.; Mallorca, F.; Marrapodi, R.; Villani, F.; Miglionico, M.; Santini, SA; Pulcinelli, F.; Gragnani, L.; Piconese, S.; Fiorilli, M. Efectos opuestos de las vacunas contra el SARS-CoV-2 basadas en ARNm y vectorizadas por adenovirus en las células T reguladoras: un estudio piloto. Biomedicinas 2023 , 11 , 511. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ren, Z.; Yang, K.; Zhu, L.; Yin, D.; Zhou, Y. Linfocitos T reguladores como desencadenante crucial y posible diana para la enfermedad hiperprogresiva tras el bloqueo de PD-1/PD-L1 para el tratamiento del cáncer. Int. Immunopharmacol. 2024 , 132 , 111934. [ Google Académico ] [ CrossRef ]
- Ohue, Y.; Nishikawa, H. Células T reguladoras (Treg) en el cáncer: ¿Pueden las células Treg ser una nueva diana terapéutica? Cancer Sci. 2019 , 110 , 2080–2089. [ Google Académico ] [ CrossRef ]
- Gao, F.-X.; Wu, R.-X.; Shen, M.-Y.; Huang, J.-J.; Li, T.-T.; Hu, C.; Luo, F.-Y.; Song, S.-Y.; Mu, S.; Hao, Y.-N.; et al. La vacunación de refuerzo prolongada contra el SARS-CoV-2 con RBD induce tolerancia inmunitaria humoral y celular en ratones. iScience 2022 , 25 , 105479. [ Google Académico ] [ CrossRef ]
- Chevaisrakul, P.; Lumjiaktase, P.; Kietdumrongwong, P.; Chuatrisorn, I.; Chatsangjaroen, P.; Phanuphak, N. Inmunidad híbrida y de grupo 6 meses después de la exposición al SARS-CoV-2 en individuos de un programa de tratamiento comunitario. Sci. Rep. 2023 , 13 , 763. [ Google Académico ] [ CrossRef ]
- Lawton, ML; Inge, MM; Blum, BC; Smith-Mahoney, EL; Bolzan, D.; Lin, W.; McConney, C.; Porter, J.; Moore, J.; Youssef, A.; et al. El perfil multiómico de linfocitos T CD4+ crónicamente activados identifica los factores que impulsan el agotamiento y la reprogramación metabólica. PLoS Biol. 2024 , 22 , e3002943. [ Google Académico ] [ CrossRef ]
- Nair, R.; Somasundaram, V.; Kuriakose, A.; Krishn, SR; Raben, D.; Salazar, R.; Nair, P. Descifrando el agotamiento de las células T en el microambiente tumoral: allanando el camino para terapias innovadoras contra tumores sólidos. Front. Immunol. 2025 , 16 , 1548234. [ Google Académico ] [ CrossRef ]
- Singh, N.; Bharara Singh, A. La subunidad S2 del SARS-CoV-2 interactúa con la proteína supresora de tumores P53 y BRCA: un estudio in silico. Transl. Oncol. 2020 , 13 , 100814. [ Google Académico ] [ CrossRef ]
- Zhang, S.; El-Deiry, WS. El ADN de la proteína Spike del SARS-CoV-2 transfectado para la expresión en células de mamíferos inhibe la activación de las proteínas P21(WAF1), del receptor de muerte TRAIL DR5 y MDM2 en células cancerosas y aumenta su viabilidad tras la exposición a quimioterapia. Oncotarget 2024 , 15 , 275–284. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kawa, S.; Kamisawa, T.; Notohara, K.; Fujinaga, Y.; Inoue, D.; Koyama, T.; Okazaki, K. Criterios de diagnóstico clínico japoneses para la pancreatitis autoinmune, 2018. Pancreas 2020 , 49 , e13–e14. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Wallace, Z. S.; Naden, R. P.; Chari, S.; Choi, H.; Della-Torre, E.; Dicaire, J.-F.; Hart, P. A.; Inoue, D.; Kawano, M.; Khosroshahi, A.; et al. Criterios de clasificación de 2019 del Colegio Americano de Reumatología/Liga Europea contra el Reumatismo para enfermedades relacionadas con IgG4. Arthritis Rheumatol. 2020 , 72 , 7–19. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Gelderloos, AT; Verheul, MK; Middelhof, I.; de Zeeuw-Brouwer, M.-L.; van Binnendijk, RS; Buisman, A.-M.; van Kasteren, PB La vacunación repetida con ARNm de COVID-19 da como resultado un cambio de clase IgG4 y una disminución de la activación de las células NK por anticuerpos específicos de S1 en adultos mayores. Inmune. Envejecimiento 2024 , 21 , 63. [ Google Scholar ] [ CrossRef ]
- Aurelia, LC; Purcell, RA; Theisen, RM; Kelly, A.; Esterbauer, R.; Ramanathan, P.; Lee, WS; Wines, BD; Hogarth, PM; Juno, JA; et al. El aumento de IgG4 del SARS-CoV-2 tiene consecuencias variables según la función de Fc, el polimorfismo del receptor Fc y la variante viral. Sci. Adv. 2025 , 11 , eads1482. [ Google Académico ] [ CrossRef ]