- 1 Departamento de Cirugía, Universidad de Pittsburgh, Pittsburgh, PA, Estados Unidos
- 2 Departamento de Inmunología, Centro de Inmunología de Sistemas, Universidad de Pittsburgh, Pittsburgh, PA, Estados Unidos
- 3 Departamento de Ciencias Matemáticas, Universidad de Indiana – Universidad Purdue de Indianápolis, Indianápolis, IN, Estados Unidos
- 4. Laboratorio de Sistemas Sintéticos, Perceptivos, Emotivos y Cognitivos (SPECS), Centro Donders de Neurociencia, Centro Donders para el Cerebro, la Cognición y la Conducta, Facultad de Ciencias e Ingeniería, Universidad Radboud, Nimega, Países Bajos
- Iniciativa 5 Salud Verdadera, Academia de Ciencias de la Salud, Londres, Reino Unido
- 6 Tangelo – Intend, Inc., Birmingham, MI, Estados Unidos
Abstracto
A medida que las poblaciones mundiales muestran niveles crecientes de estrés, comprender los vínculos emergentes entre el estrés, la inflamación, la cognición y el comportamiento es vital para la salud humana y planetaria. Planteamos la hipótesis de que la inflamación es un factor multiescala que conecta los factores estresantes que afectan a los individuos con disfunciones sociales a gran escala y, en última instancia, con impactos ambientales a escala planetaria. Proponemos la hipótesis del «mapa central de la inflamación» para explicar cómo el cerebro regula la inflamación y cómo esta afecta la cognición, la emoción y la acción. Según nuestra hipótesis, estos procesos inflamatorios y neuronales interdependientes, y la transmisión interindividual de factores estresantes ambientales, infecciosos y conductuales —amplificados mediante comunicaciones globales digitales de alto rendimiento— pueden culminar en un proceso multiescala, descontrolado y de propagación anticipada que podría afectar negativamente la toma de decisiones y el comportamiento humano a gran escala, lo que en última instancia perjudica la capacidad de abordar estos mismos factores estresantes. Esta perspectiva podría proporcionar explicaciones no intuitivas para los comportamientos y las relaciones entre células, organismos y comunidades de organismos, incluyendo potencialmente respuestas poblacionales a factores estresantes tan diversos como el cambio climático global, los conflictos y la pandemia de COVID-19. Para ilustrar nuestra hipótesis y dilucidar sus fundamentos mecanicistas, presentamos un modelo matemático aplicable a nivel individual y social para evaluar los vínculos entre el estrés, la inflamación, el control y la curación, incluyendo las implicaciones de la transmisión, la intervención (p. ej., mediante modificaciones del estilo de vida o medicación) y la resiliencia. Se requieren investigaciones futuras para validar los supuestos y conclusiones del modelo frente a parámetros empíricos y para ampliar los factores/variables empleados. Nuestro modelo ilustra la necesidad de intervenciones multicapa y multiescala para la mitigación del estrés, incluyendo medidas del estilo de vida, terapias de precisión y el diseño de ecosistemas humanos. Nuestro análisis muestra la necesidad de un esfuerzo de investigación coordinado, interdisciplinario e internacional para comprender la naturaleza multiescalar del estrés. Hacerlo informaría la creación de intervenciones que mejoren la vida de las personas; aumenten la resiliencia de las comunidades al estrés; y mitiguen los efectos adversos del estrés en el mundo.
Puntos clave
- Comprender los vínculos entre el estrés, la inflamación, el estado mental y el comportamiento es de vital importancia para la salud humana y planetaria.
- Según nuestra hipótesis, la inflamación actúa como un impulsor multiescala que conecta los factores estresantes que afectan a los individuos con disfunciones sociales a gran escala y, en última instancia, con impactos a escala planetaria sobre el medio ambiente, que a su vez impulsan el estrés inflamatorio a través de un ciclo de retroalimentación positiva.
- Proponemos una hipótesis de “mapa de inflamación central” para explicar cómo el cerebro regula la inflamación y cómo la inflamación perjudica la percepción, la emoción, la cognición, la conciencia y el comportamiento.
- Los procesos inflamatorios y neuronales interdependientes y la transmisión interindividual de factores estresantes ambientales e infecciosos —amplificados mediante comunicaciones globales digitales de alto rendimiento— culminan en un proceso descontrolado, de propagación hacia adelante y de múltiples escalas que podría afectar negativamente la toma de decisiones y el comportamiento humanos a gran escala, perjudicando en última instancia nuestra capacidad para abordar estos mismos factores estresantes tanto a nivel individual como poblacional.
- Proponemos un modelo matemático que puede utilizarse para dilucidar y probar los vínculos entre el estrés, la inflamación, el control/cognición neuronal y la curación, con las consiguientes implicaciones en la transmisión del estrés, la posible intervención (por ejemplo, mediante modificación del estilo de vida o medicación) y la resiliencia.
- Se necesita un esfuerzo de investigación internacional interdisciplinario y coordinado para definir intervenciones que mejoren la vida de las personas y la resiliencia de las comunidades al estrés, involucrando intervenciones de mitigación del estrés de múltiples capas y múltiples escalas que cubran medidas de estilo de vida, terapias de precisión y diseño de ecosistemas humanos.
Introducción: vivir en un estado de inflamación
La inflamación es un proceso biológico que ha evolucionado para permitir a los organismos detectar y responder tanto al estrés beneficioso como al excesivo causado por estímulos internos o externos ( 1–5 ) . Es un proceso altamente conservado, regulado por complejos mecanismos inmunológicos, neuronales y hormonales ( 6 ) . Las perturbaciones en estos mecanismos subyacen a diversas enfermedades inflamatorias agudas y crónicas (p. ej., enfermedades infecciosas, enfermedades críticas, enfermedades cardiovasculares, cáncer y enfermedades autoinmunes) que, en conjunto, representan una importante carga para la salud mundial ( 7 ).
Hoy en día, la mayoría de las personas viven en lo que podría decirse que es una era relativamente pacífica en comparación con gran parte del siglo XX y antes. Sin embargo, existe la sensación de que hay muchas cosas que no van bien a nivel individual, comunitario, nacional y mundial. Informes recientes sugieren que la población mundial está sometida a más estrés que nunca (8–11 ) . Este proceso está empeorando, dada la exposición común a las preocupaciones sobre el cambio climático y la salud planetaria ( 12 ), la agitación social, la incertidumbre económica, la inseguridad alimentaria, la guerra y, para muchas personas, la impresión de olas de enfermedades aparentemente interminables que afectan al planeta ( 13–16 ). La delimitación cada vez mayor de los factores estresantes ha dado lugar al término «exposoma», utilizado para definir la suma de las exposiciones ambientales dañinas ( 17 ) . Estos problemas se ven amplificados por las disparidades y las marcadas variaciones en los determinantes sociales de la salud ( 18 , 19 ). A estos factores estresantes acumulativos se les ha denominado “policrisis”, y se han hecho intentos iniciales para definir este término y sus manifestaciones sociales ( 20 ).
La sensación de pavor derivada de la “policrisis” intensifica aún más el estrés y su expresión somática. La exposición a estresores acumulativos no es un fenómeno nuevo, por supuesto. Sin embargo, lo que no tiene precedentes es la tasa y la densidad de la transferencia de estrés dentro y entre poblaciones a nivel mundial a través de Internet. Por ejemplo, el aumento de la depresión adolescente (una comorbilidad del estrés) se correlaciona estrechamente con el aumento del uso de las redes sociales ( 21 ). Si bien el impacto de los algoritmos de recomendación de las redes sociales es complejo, y el uso de las redes sociales puede evitar el estrés al permitir que los usuarios expresen sus sentimientos, estos algoritmos también pueden desencadenar vías de radicalización impulsadas por narrativas negativas, aumentar la sensación de peligro y, por lo tanto, aumentar el estrés ( 22 ). Estas vías se moldean algorítmicamente y emergen debido a la explotación del acoplamiento causal de estresores, emociones y comportamiento de elección al servicio de la economía ( 23 ).
Sugerimos que esta mayor sensación de peligro constante y ubicuo es en sí misma quizás un factor estresante tan insidioso como los eventos que se comunican a través de las redes sociales, y sugerimos además un vínculo directo entre la inflamación y esta sensación generalizada de estrés. Muchos estudios sugieren que todo estrés, ya sea «real» o virtual, induce una respuesta inflamatoria que afecta los órganos, las vías neuronales, la experiencia y el comportamiento a lo largo de la vida ( 24 , 25 ) . Lo contrario también es cierto: los mecanismos neuronales que evolucionaron para regular la inflamación ( 26-28 ) pueden verse abrumados cuando el estrés es constante y omnipresente, lo que perjudica la cognición ( 29 , 30 ) y aumenta la percepción y la experiencia del estrés. De hecho, como la mente se construye alrededor de modelos del mundo autoconstruidos, la exposición constante a factores estresantes sesgará estos modelos internos que dan forma a nuestra percepción, experiencia y comportamiento ( 29 ). Esto plantea la pregunta de si la noción de inflamación debería expandirse más allá del sustrato biológico y las redes de síntomas. En particular, el enfoque de redes en la psicopatología postula que los trastornos mentales pueden conceptualizarse y estudiarse como sistemas causales de síntomas que se refuerzan mutuamente ( 31 ).
Aquí, presentamos la hipótesis de que la inflamación actúa como un factor impulsor multiescalar integrado que conecta la mayoría o todos los factores estresantes que afectan a los individuos con disfunciones sociales a gran escala y, en última instancia, con impactos ambientales a escala planetaria. Estos, a su vez, impulsan el estrés inflamatorio mediante un ciclo de retroalimentación positiva. Nuestro marco se basa en la naturaleza interrelacionada de la inflamación en los sistemas orgánicos, los procesos neuronales, la cognición, la experiencia, el comportamiento y la transmisión interindividual del estrés, así como en la aplicación de los principios del estrés inflamatorio en células e individuos a poblaciones de individuos que actúan en sintonía. Dado que el sistema nervioso central (SNC) regula la inflamación y los mediadores inflamatorios afectan la neurotransmisión, planteamos la hipótesis de que el estrés proinflamatorio altera los procesos mentales humanos a múltiples niveles. Argumentamos que estos procesos inflamatorios y neuronales interdependientes, y la transmisión interindividual de estresores ambientales, microbianos e informativos, amplificados mediante comunicaciones globales digitales de alto rendimiento (es decir, Internet y las redes sociales), culminan en un proceso de propagación descontrolada y multiescala que podría afectar negativamente la toma de decisiones y el comportamiento humanos, y en última instancia, perjudicar nuestra capacidad para abordar estos mismos estresores individuales y globales. A escala, esto podría tener consecuencias sociales y ambientales de gran alcance, contribuyendo potencialmente a las respuestas caóticas y contraintuitivas de grandes sectores de la población mundial a estresores tan diversos como el cambio climático global, los conflictos y la pandemia de COVID-19. Como se señaló anteriormente, el juicio afectado por el estrés puede propagar una sensación autocumplida de peligro generalizado, causando más estrés y estableciendo un ciclo de retroalimentación positiva descontrolada de estrés a través de la retroalimentación conductual ( 32 ). De este modo, la inflamación se reformula como un proceso multiescala que vincula las interacciones moleculares con los resultados sociales y planetarios globales.
Después de detallar esta hipótesis, probamos sus implicaciones cualitativas utilizando un modelo matemático que vincula los procesos relevantes y utilizamos los conocimientos de este ejercicio para informar estrategias de mitigación de múltiples escalas y capas y áreas para futuras investigaciones interdisciplinarias.
Estrés e inflamación: de la célula al globo
Una definición práctica del estrés
El «estrés» generalmente se refiere a estímulos que evocan una respuesta defensiva, conocida popularmente como «lucha o huida» en humanos. Si bien la lucha o la huida se relaciona más claramente con las acciones de un animal autónomo e individual, sugerimos que este concepto puede adaptarse a las acciones defensivas de células, comunidades celulares, órganos, sistemas orgánicos, individuos y comunidades de individuos. Por lo tanto, nuestra hipótesis es que cuando el estrés se mantiene más allá de ciertos parámetros de resiliencia individual, se entra en un régimen de indefensión aprendida ( 33 ), que se ha relacionado con comportamientos socialmente adversos, como la adhesión a teorías conspirativas ( 34 ).
Generalmente, un organismo que interpreta el estrés como una «acción» que ocurre en su contra reacciona de manera análoga a la lucha, la huida o la rendición. Ante una provocación adecuada (es decir, un factor estresante), las células y los organismos unicelulares pueden expresar una gama de respuestas bioquímicas y biológicas defensivas, incluyendo la síntesis de diversos compuestos moleculares, alteraciones estructurales (como el enquistamiento) y, en casos extremos, la apoptosis u otros modos de muerte celular programada ( 35 ). A continuación, presentamos una definición práctica de la inflamación y detallamos las interrelaciones entre la inflamación y el estrés.
Una definición práctica de inflamación
En organismos multicelulares, el estrés es transmitido y amplificado por células inflamatorias y sus productos. De hecho, dada una señal de estrés apropiada y suficiente, la mayoría de las células del cuerpo montarán una reacción que califica como inflamatoria ( 36–38 ) . Los glóbulos blancos, por ejemplo, se despliegan en masa dentro del cuerpo para contrarrestar una provocación inmunogénica. Mientras que los químicos generados por organismos unicelulares se dirigen casi exclusivamente «hacia afuera» (los compuestos que alteran la expresión génica, es decir, las acciones epigenéticas, son una excepción), aquellos producidos por organismos multicelulares pueden ejercer efectos dirigidos tanto hacia afuera como hacia adentro. Los ejemplos de efectos hacia adentro incluyen aquellos mediados por compuestos que se unen a receptores dentro del mismo cuerpo para amplificar, reducir o alterar de otra manera la coreografía de las células o la cascada de otros mediadores químicos y cualquier efecto quimiotáctico que altere las acciones dirigidas de células inmunes dedicadas ( 2 ). En organismos superiores, las células inician señales de alarma/peligro (también conocidas como moléculas de patrón molecular asociado a daño [DAMP]) que activan las células inflamatorias residentes en los tejidos para que secreten quimiocinas y citocinas inflamatorias ( 4 , 39 ), que a su vez estimulan la producción de radicales de oxígeno y nitrógeno y otras toxinas celulares ( 35 ). Esta cascada conduce a la creación de más DAMP por parte de las células inflamatorias, así como al daño de células parenquimales adicionales, es decir, células específicas de órganos, lo que impulsa un ciclo de avance de daño → inflamación → daño a nivel de célula/microbiota, tejido, órgano y, en última instancia, a nivel de todo el organismo ( 2 , 40 ) ( Figura 1 ). Los estresores externos también pueden desencadenar efectos epigenéticos, es decir, producir cambios estables en el genoma ( 41 ). Por ejemplo, se han informado cambios epigenéticos relacionados con la depresión y el estrés en varios genes, incluidos los involucrados en la señalización de glucocorticoides, la señalización serotoninérgica y las neurotrofinas ( 30 ).
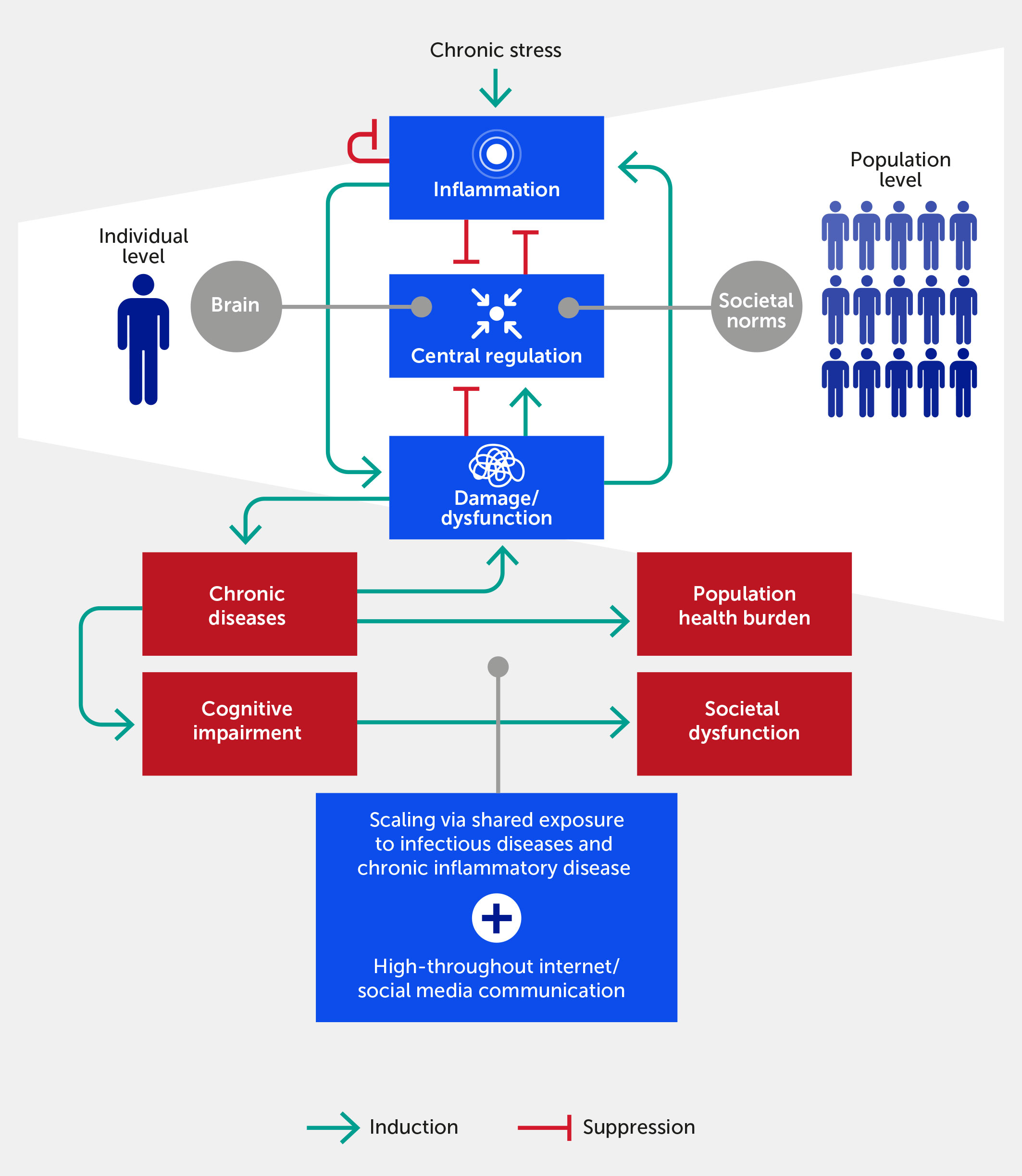 Figura 1. La respuesta inflamatoria en individuos se retroalimenta a través de su impacto en el daño/disfunción fisiológica. Este daño deteriora la función neurológica y epigenética y la capacidad del sistema nervioso para regular la inflamación (es decir, distrés), aunque argumentamos que dentro de cierto rango (es decir, eustrés) el estrés puede mejorar el control central a través de una mayor resiliencia. Dada la exposición ubicua a enfermedades infecciosas, factores de enfermedades inflamatorias agudas y crónicas, y la transmisión del estrés a través de la comunicación por Internet/redes sociales, este proceso se escala a nivel poblacional. En este paradigma, la inflamación crónica inducida por estrés impacta negativamente la función social si se consideran las normas y procesos sociales como el análogo de los mecanismos alostáticos/homeostáticos biológicos. Proponemos que el ciclo de retroalimentación positiva entre el daño y la inflamación puede generalizarse a los dominios cognitivo y poblacional. Las flechas hacia adelante indican la activación o promoción de una interacción particular, mientras que las flechas romas indican inhibición.
Figura 1. La respuesta inflamatoria en individuos se retroalimenta a través de su impacto en el daño/disfunción fisiológica. Este daño deteriora la función neurológica y epigenética y la capacidad del sistema nervioso para regular la inflamación (es decir, distrés), aunque argumentamos que dentro de cierto rango (es decir, eustrés) el estrés puede mejorar el control central a través de una mayor resiliencia. Dada la exposición ubicua a enfermedades infecciosas, factores de enfermedades inflamatorias agudas y crónicas, y la transmisión del estrés a través de la comunicación por Internet/redes sociales, este proceso se escala a nivel poblacional. En este paradigma, la inflamación crónica inducida por estrés impacta negativamente la función social si se consideran las normas y procesos sociales como el análogo de los mecanismos alostáticos/homeostáticos biológicos. Proponemos que el ciclo de retroalimentación positiva entre el daño y la inflamación puede generalizarse a los dominios cognitivo y poblacional. Las flechas hacia adelante indican la activación o promoción de una interacción particular, mientras que las flechas romas indican inhibición.
El carácter integrado, multiescalar y de propagación hacia adelante de la inflamación es necesario para responder rápidamente a amenazas o lesiones, posiblemente a lo largo de generaciones, pero también es un factor clave de patología en todas las escalas de organización ( 42–44 ) . Esto se combina con causas preexistentes de inflamación en forma de enfermedades agudas y crónicas ( 7 ). El mayor estado de alarma en nuestra sociedad significa que una gran proporción de la población humana está potencialmente predispuesta a la inflamación inducida por estrés en un momento dado. Es importante destacar que el estrés puede ser constructivo (es decir, eustrés) o destructivo (es decir, distrés), y la inflamación puede estar bien regulada y mejorar la función o desregulada y promover la disfunción. Esta constatación, a su vez, ofrece una base inicial para priorizar y gestionar las respuestas al estrés y para diferenciar entre respuestas inflamatorias esenciales y constructivas frente a la inflamación disfuncional. El paradigma «interior versus exterior» mencionado anteriormente puede profundizarse aún más, dado que los individuos pueden considerarse como «comunidades del yo» complejas ( 45 ), especialmente al considerar el microbioma ( 46 ), además de nuestras diversas células y tejidos. De igual manera, dado el reciente acceso a la información que se difunde a través de las redes sociales, los humanos han ampliado considerablemente su capacidad de acción exterior.
Las interacciones multiescala entre el estrés y la inflamación se propagan dentro de los individuos y entre ellos.
Consideramos que los agentes biológicos comprenden redes integradas, desde genes y neuronas hasta pensamientos y comportamientos ( 47 ). Nuestras células están sujetas a un estrés casi constante, y se cree que el imperativo de mantener la homeostasis ha llevado a la evolución de múltiples mecanismos para detectar, responder y adaptarse tanto a estresores exógenos (p. ej., debido a infecciones microbianas, lesiones o estímulos nocivos) como endógenos (metabólicos) a lo largo de nuestra vida; de hecho, la inducción de mecanismos de respuesta al estrés es una característica importante del envejecimiento ( 43 , 48–50 ) . Además, cuando se estresa, nuestra microbiota comensal puede volverse virulenta y promover un mayor estrés proinflamatorio ( 51 ). La homeostasis en sí misma está regulada a través de procesos alostáticos ( 52 ) que adaptan los bucles de control homeostático a las necesidades internas y las oportunidades externas, encontrando estabilidad orgánica a través del cambio homeostático continuo. Sin embargo, estos circuitos reguladores pueden fallar cuando se perturban, como en situaciones de sepsis ( 51 , 53 ) o trauma/hemorragia ( 54 ).
Proponemos que estos mismos principios de estrés e inflamación se aplican a comunidades o poblaciones de individuos que actúan en conjunto ( Figura 1 ). En apoyo de esta idea, la constelación de factores estresantes, incluidos el cambio climático y la contaminación ambiental, se ha vinculado a una reducción significativa del crecimiento, la supervivencia y la diversidad del microbioma de las comunidades vegetales ( 55 ). En el contexto humano, un ejemplo clave de una respuesta de estrés agudo en toda la comunidad es cualquier versión de conflicto civil o guerra, mientras que una crónica es una reducción de las tasas de natalidad y la esperanza de vida. Al extender este paradigma al nivel de la población, observamos que un estrés o una provocación (p. ej., guerra o pandemia) incita una respuesta coordinada entre las partes componentes (p. ej., civiles, políticos, soldados individuales o trabajadores de la salud) de un superorganismo que participa en el mismo conjunto pequeño de opciones de respuesta (es decir, lucha, huida o rendición). A nivel biológico, los individuos comunican estrés a otros individuos en un proceso llamado “contagio de estrés” ( 56 , 57 ), por ejemplo, a través de feromonas ( 58 ), y por lo tanto probablemente exacerban sus respuestas inflamatorias. Nuestra hipótesis es que esta es una causa adicional de la comunicación de estrés a nivel comunitario, y posiblemente global, además de la exposición compartida a estresores infecciosos y enfermedades inflamatorias crónicas altamente prevalentes ( Figura 1 ). De hecho, la hipótesis de que la psicopatología puede entenderse en términos de redes de síntomas proporciona un vínculo causal directo entre los sustratos biológicos y las vías del estrés y las vías psicológicas, sociales y culturales ( 47 ). Avanzamos que estas vías se han perturbado patológicamente no solo a través de los efectos agregados del exposoma moderno ( 12 , 59 ), sino también a través de la posible amplificación de tales efectos a través de canales de información de alto rendimiento en la era de Internet ( 60 , 61 ).
Planteamos la hipótesis de que la inflamación desregulada se produce cuando los mecanismos de respuesta al estrés multiescala ya no son suficientes para mitigar el estrés, y cuando la combinación de estrés interno y externo excede nuestra resiliencia al estrés individual o colectivo ( Figura 1 ). En la línea de base, el estado inflamatorio está restringido a través de múltiples puntos de control ( 36 ) porque la respuesta inflamatoria ha evolucionado para aumentar vigorosamente a través de retroalimentación positiva para lidiar rápidamente con amenazas relativamente no específicas ( 2 ). Por el contrario, la resolución de la inflamación ocurre más lentamente ( 62 ), lo que sugiere que las respuestas inflamatorias están reguladas por una carrera entre los procesos de retroalimentación que propagan la inflamación autosostenida versus los procesos de resolución de la inflamación con menos bucles de retroalimentación positiva ( 40 ).
Estos bucles de retroalimentación de inducción y resolución multiescala se manifiestan dentro de los individuos tanto espacial como temporalmente ( 63 ). Si bien la inflamación es, en algún nivel, inherentemente local (es decir, ocurre en un tejido u órgano), la respuesta inflamatoria puede propagarse a través de múltiples tejidos y manifestarse sistémicamente ( 2 , 42 , 53 , 54 , 63 ), por ejemplo, en la patología de enfermedades críticas ( 63–65 ) y otras enfermedades. En particular, la retroalimentación negativa sobre la inflamación puede manifestarse localmente, sistémicamente (si la respuesta inflamatoria se extiende a la circulación sistémica) y centralmente (a través de mecanismos reguladores neuronales; véase más adelante) ( 6 , 66 , 67 ) ( Figura 1 ). Proponemos que este tipo de propagación, con las causas y consecuencias mencionadas anteriormente, también se aplica a poblaciones de humanos que responden a señales de estrés de otros individuos y su entorno natural y artificial.
Sugerimos que el rápido aumento de la inflamación es el talón de Aquiles de este proceso generalmente beneficioso, es decir, que el flujo de estrés inflamatorio del individuo a la población y viceversa está en la raíz del estrés a escala global y sus patologías asociadas, incluida la disfunción cognitiva y, por lo tanto, la disfunción conductual ( Figura 1 ). En sistemas biológicos complejos, la robustez y la flexibilidad funcional se logran a través de una fragilidad paradójica en las llamadas «restricciones que liberan» ( 68 , 69 ). En nuestro paradigma, la naturaleza inherente de retroalimentación e incrustada en los tejidos de la respuesta inflamatoria, junto con las interacciones cercanas con los sistemas de control del SNC, crea tanto robustez como fragilidad. La robustez se produce a través de los mecanismos de control multicapa, multiescala, dinámicos y recíprocos que vinculan el estrés, la inflamación y el control neuronal y la función conductual. Al mismo tiempo, se produce fragilidad a través de una inflamación desregulada que se propaga rápidamente por múltiples tejidos en forma multiescalar, dando lugar a disfunción en múltiples órganos, así como a desregulación de emociones, cognición, experiencia y comportamiento, que pueden transmitirse entre individuos.
El cerebro es un sustrato clave en esta cascada de estrés, inflamación y disfunción. Por un lado, los ejes hipotálamo-hipofisario-adrenal (HPA) y simpático-adrenal-medular (SAM) vinculan el estrés con la función cerebral, incluyendo el control ejecutivo ( 70 ) y el sistema inmunitario ( 71 ). De hecho, existen indicios de una relación directa entre los trastornos del estado de ánimo y los niveles elevados de marcadores inflamatorios en la sangre ( 72 ). Además, el cerebro impulsará las acciones que actúan como factores estresantes en el mundo exterior, lo que podría desencadenar cascadas de estrés colectivo en la población.
Nuestro paradigma se extiende más allá de una perspectiva puramente de abajo hacia arriba sobre el estrés y la inflamación e incluye un componente de arriba hacia abajo. Por ejemplo, la alarma en forma de amenazas interpersonales, ya sean directas ( 73 ) o a largas distancias a través de medios digitales ( 22 , 61 , 74 ) , junto con la ansiedad por el estado de la sociedad , el cambio climático, las enfermedades infecciosas, el nivel socioeconómico, etc. ( 8 , 13-15 , 75 ), pueden considerarse tan proinflamatorias como los estímulos explícitamente biológicos, como las infecciones graves o las enfermedades crónicas. Estas tensiones interpersonales se propagan entre individuos dentro y entre poblaciones, con una onda expansiva interna y externa que impacta los procesos globales de múltiples maneras ( Figura 1 ). Al igual que en entornos biológicos de inflamación, la reiniciación repetida de respuestas inflamatorias de nivel relativamente bajo puede reducir el umbral de activación para la retroalimentación positiva en múltiples individuos dentro de una comunidad o sociedad. Este fenómeno, llamado «cebado» en el contexto celular/molecular de la inflamación, es parte de un fenómeno más amplio de preacondicionamiento que también incluye el proceso de retroalimentación negativa de tolerancia/desensibilización. A nivel poblacional, sugerimos que el cebado conduce a un estado en el que el estrés puede explotar en una sociedad, incluso en la (aparente) ausencia de un único estímulo proinflamatorio definido, debido a una respuesta de resolución disminuida. El proceso paralelo de tolerancia/desensibilización al daño personal y social cada vez mayor es impulsado por el exceso de retroalimentación negativa ( 76 , 77 ). Ambos procesos comprenden el fenómeno del preacondicionamiento, pueden modelarse matemáticamente ( 78 , 79 ) y son un aspecto clave del paradigma inflamatorio global propuesto aquí.
Según nuestro paradigma, se podría esperar que la intensidad actual del estrés y su transmisión a múltiples escalas se traduzca en una concentración comparable de desorden social y violencia que amplifica el estrés y la inflamación. Que esto aparentemente no ocurra ( 80 ) sugiere una amplificación proporcional de las funciones de «control» en las sociedades modernas, desde la autoridad de la ciencia y la medicina y la confianza en nuestras instituciones, hasta organizaciones multinacionales como las Naciones Unidas y la Organización del Tratado del Atlántico Norte (OTAN), hasta la interdependencia fomentada por el comercio global ( 81 ). Sin embargo, todas estas funciones de control están siendo cuestionadas actualmente y podría decirse que se han degradado. El desafío ahora es cómo los humanos pueden prepararse mejor para el escenario negativo emergente: una nueva era adversaria de inestabilidad debido a una combinación de estrés global y colapso ecológico.
El cerebro y el estrés inflamatorio
La hipótesis del “mapa central de la inflamación”
Proponemos que el sistema nervioso y la cognición en individuos y las formas de intercambio simbólico que permite, y el papel conceptualmente paralelo que desempeñan las reglas sociales en las comunidades de individuos, vinculan el estrés, la inflamación y la disfunción individual y social. Como se señaló anteriormente, los organismos superiores han desarrollado una arquitectura de retroalimentación negativa a múltiples escalas para controlar la inflamación, que en parte involucra mecanismos neuronales. Un mecanismo neuronal clave que regula la inflamación tanto a nivel local como sistémico involucra al nervio vago ( 26 ), con circuitos neuronales que actúan para limitar el grado en el que se expresan los mediadores inflamatorios después de un estímulo proinflamatorio ( 27 , 28 ). La evidencia reciente sugiere que el nervio vago no solo regula el grado en el que se induce la inflamación, sino que también limita la propagación de la inflamación a través de tejidos y órganos ( 82 ). Extendemos este paradigma al plantear la hipótesis de que, en condiciones fisiológicas, el control neuronal de la inflamación ocurre en parte a través de un tipo de «capa de abstracción de hardware», un término que tomamos prestado de la ciencia de la computación y que se refiere a la división lógica del código en el que el hardware de la computadora se controla a través del software ( 83 ). Otra forma de pensar en esto es en términos de las «restricciones que liberan»: al haber desarrollado protocolos y sustratos específicos (es decir, restricciones), los sistemas biológicos ofrecen un amplio conjunto de adaptaciones desconocidas a priori (es decir, liberadas) en la expresión funcional ( 84 , 85 ). Nuestra hipótesis es que la arquitectura neuroinmunológica se basa en la regulación neuronal central, invocando e involucrando las mismas citocinas inflamatorias que impulsan la inflamación en los tejidos periféricos. Con esto queremos decir que el cerebro puede expresar los mismos mediadores inflamatorios expresados en los órganos distales inflamados para construir un mapa corporal completo de la inflamación; nuestra hipótesis es que este «mapa de inflamación central» es un mecanismo para la regulación central de la respuesta inflamatoria. Como ejemplo, esta hipótesis se ve respaldada por investigaciones en modelos de roedores que muestran que la administración intrabronquial de un inmunoestimulante derivado de bacterias (endotoxina gramnegativa) de una manera que no produce la manifestación sistémica de mediadores inflamatorios, da lugar a la expresión tanto pulmonar como cerebral del mediador inflamatorio clave, la interleucina (IL)-1β ( 86 ). Por el contrario, la inyección de IL-1β en el núcleo del tracto solitario del tronco encefálico es suficiente para replicar los trastornos funcionales en la fisiología pulmonar inducidos por las endotoxinas ( 87 ) y la toxina bleomicina ( 88).). Otro ejemplo es el supuesto vínculo causal entre el estrés, la inflamación y la disfunción del hipocampo y la corteza prefrontal medial, que puede considerarse el resultado de múltiples procesos neurotóxicos ( 89 ). Uno de estos procesos es la disfunción del eje HPA, causada por el estrés crónico y el aumento de la producción de citocinas inmunitarias mediadas por células, lo que conduce a un agotamiento de serotonina, un aumento del glutamato y del estrés oxidativo, y una reducción del control inhibitorio mediado por el ácido gamma-aminobutírico (GABA), lo que a su vez resulta en daño celular y reducción del volumen ( 90 , 91 ).
Por lo tanto, nuestra hipótesis integra la inflamación en cómo percibimos y evaluamos la realidad y la moldeamos a través de nuestras acciones, cerrando un ciclo continuo de retroalimentación conductual entre el individuo y su mundo físico y social ( 29 ). Además, sugerimos que este paradigma ofrece un mecanismo por el cual el estrés y la inflamación crónica podrían resultar en una cognición y acción desreguladas, que sin control podrían, a su vez, impulsar disfunción psicológica a nivel individual y, en última instancia, impulsar disfunción social. El apoyo inicial para esta hipótesis proviene del hallazgo de que las personas con trastornos neuroinmunes a menudo experimentan «niebla mental» ( 92 ) que puede perjudicar su toma de decisiones ( 93 ). El apoyo adicional proviene de las asociaciones conocidas de los trastornos cognitivos con la desregulación inmunológica ( 29 , 30 ) y la relación directa entre el estrés y la memoria ( 94 ), que, sin embargo, parece robusta contra el estrés «cotidiano» ( 95 ).
Un punto relacionado es que las citocinas expresadas en el cerebro supuestamente comunican inflamación en órganos distales y regulan positivamente su expresión. Siguiendo con el ejemplo de IL-1β, esta citocina puede inducir una mayor expresión de sí misma ( 96 ). Podemos especular que los episodios repetidos de inflamación, junto con la activación constante de las vías neuronales de detección y regulación en respuesta al estrés real o percibido, podrían ser la base del papel reportado de IL-1β en la patobiología de afecciones neurodegenerativas como la enfermedad de Alzheimer ( 97 ) y otros aspectos de la cognición ( 29 , 30 ), y también conducir a una mayor sensibilización a las vías de estrés e inflamación. Una vez que estos efectos afectan el control de la acción, pueden extenderse al mundo exterior.
A continuación, analizamos factores adicionales que inciden en el estrés, la inflamación y la función neuronal, cómo vinculan a los individuos con su entorno y cómo estos factores pueden escalar desde el individuo hasta la población y viceversa.
La alteración del sueño agrava el estrés inflamatorio
La alteración del sueño es un factor clave que contribuye al ciclo continuo de inflamación y degradación potencial del bienestar y la cognición. A nivel individual, el sueño se ve afectado negativamente por la inflamación, que a su vez deteriora la función cognitiva tanto a corto como a largo plazo ( 98 ). El sueño reparador depende en gran medida de los ciclos hormonales, conocidos generalmente como ritmos circadianos. Desde una perspectiva global, estos ciclos representan una alineación de los biorritmos con los ciclos planetarios de luz y oscuridad ( 99 ); en particular, los ritmos circadianos se han implicado en la alostasis y la resiliencia al estrés ( 100 ). Si bien la hormona pineal, la melatonina, se asocia más prominentemente con variaciones en el estado de alerta y la somnolencia ( 101 ), sus efectos se extienden a las influencias en otras hormonas, incluyendo el cortisol, las catecolaminas, la hormona del crecimiento, la leptina y la grelina ( 102 , 103 ). La inflamación crónica es tanto causa como efecto de perturbaciones hormonales, en particular elevaciones persistentes de cortisol y catecolaminas. A su vez, estas perturbaciones pueden fomentar la insensibilidad a la insulina y elevar los niveles de insulina, deteriorando aún más la homeostasis endocrina ( 104 , 105 ). Es importante destacar que la interrupción de los ritmos circadianos en el contexto del estilo de vida mencionado anteriormente se asocia con impactos adversos adicionales en el metabolismo ( 106 ). Finalmente, estudios recientes también conectan la disfunción cognitiva inducida por la privación del sueño con alteraciones del microbioma intestinal ( 107 ), lo que respalda el impacto antes mencionado del estrés acumulativo en comunidades de organismos ( 55 ) a través de los efectos adversos de la desregulación del sueño en la cognición y la acción.
Con el tiempo, las repercusiones hormonales de la inflamación tienden a alterar la señalización del apetito y favorecen el consumo excesivo de alimentos y el crecimiento (tanto en tamaño como en número) de los adipocitos ( 108 ). También se produce infiltración grasa de otras células (en particular, los hepatocitos), lo que provoca disfunción metabólica y mayor inflamación ( 109 , 110 ). Estas vías sabotean la ritmicidad circadiana, lo que perjudica el sueño a través de un mecanismo hormonal ( 111 ). El aumento excesivo de peso y la adiposidad también pueden perjudicar el sueño a través de una vía mecánica, ya que están relacionados con la laxitud del paladar posterior, los ronquidos y la apnea del sueño ( 112 ). Acumulativamente, estos factores aumentan el estrés en el organismo.
Los efectos estresantes de la inflamación sobre el sueño son recíprocos. La alteración del sueño altera aún más los patrones circadianos, exacerbando los trastornos hormonales. El aumento del dolor crónico y la tensión psicológica perjudican el sueño y aumentan las respuestas inflamatorias, mientras que la privación del sueño se asocia con reducciones en la tolerancia al dolor y al estrés psicológico, lo que potencia los efectos tanto del dolor como del estrés. El resultado de estas interacciones es un ciclo de retroalimentación negativa, en el que la inflamación altera el sueño y la privación del sueño la amplifica ( 104 , 105 , 113 ), lo que desencadena vías sintomáticas acopladas a múltiples escalas que amplifican el estrés.
La competencia por los recursos impulsa el estrés inflamatorio
La competencia por los elementos esenciales para la supervivencia (agua, alimento, refugio y pareja) es una fuente primordial y universal de estrés en individuos y poblaciones. Esto puede complementarse además con elementos esenciales para la supervivencia social que subyacen al florecimiento, como los vínculos afectivos, la afirmación y el reconocimiento. El grado de estrés varía con la intensidad de dicha competencia y la urgencia de la necesidad insatisfecha. La competencia por recursos limitados varía directamente con la densidad de población, lo que se traduce en un desencadenante fundamental de la inflamación asociada al estrés e impactos en la cognición y el comportamiento, como se describió anteriormente. Los estudios en animales demuestran sistemáticamente los efectos adversos del hacinamiento en el estrés y las respuestas inflamatorias ( 114–116 ) . Los estudios en humanos sobre el impacto del hacinamiento y fenómenos relacionados, como la violencia relacionada con el ámbito socioeconómico (117–119) y el estrés relacionado con el trabajo (120–122 ) , sugieren lo mismo , aunque es difícil separar los impactos de las enfermedades crónicas y otros factores del estrés laboral ( 123 , 124 ). Tanto las investigaciones realizadas en animales como en humanos han implicado varias vías, incluidas alteraciones del HPA y del microbioma ( 114 , 125 ).
El potencial de estos factores ambientales para desencadenar respuestas inflamatorias dentro de las comunidades adquiere mayor importancia en el contexto del crecimiento de la población: la población humana mundial se ha cuadruplicado durante el último siglo ( 126 ). Como se sugirió anteriormente, las respuestas inflamatorias de las poblaciones pueden considerarse análogas a las de los individuos: es decir, lucha, huida o rendición. En el caso de los elementos esenciales para la supervivencia, como la comida y el agua, la rendición es potencialmente suicida. A medida que aumentan las presiones globales sobre dichos recursos, las opciones de «huida» a la seguridad se vuelven cada vez más limitadas. El resultado inevitable es un mayor recurso a la respuesta de «lucha», ya sea entre individuos dentro de una población o entre poblaciones. La densidad de población que intensifica la competencia y el estrés también sirve para (a) agotar recursos críticos y generar escasez que agrava las urgencias de la competencia y (b) situar a los competidores cada vez más cerca unos de otros en números cada vez mayores. Es importante destacar que el estrés contemporáneo impulsado por la competencia no necesita ser causado solo por estímulos proximales: con Internet y varias formas de comunicación casi instantánea, el estrés de la competencia por recursos se ha vuelto más intenso y se ha desplazado al dominio social por la explotación algorítmica de las necesidades psicológicas. La competencia está disociada de las ubicaciones espaciales (es decir, ahora puede aparecer desde cualquier rincón del planeta debido a la globalización), comprimida en el tiempo y enfocada en nuevas cualidades, indicadores y monedas, como la afirmación social. Esta escalada e intensificación de la competencia a través de medios digitales aumentará, directa e indirectamente, los niveles de estrés, exacerbando aún más la inflamación. Esto se ilustra con la relación entre el uso de las redes sociales y la depresión y el suicidio adolescente ( 21 ). Efectivamente, estos medios digitales ahora pueden convertirse en un sustrato social y cultural de la inflamación, que continuamente impulsa más estrés.
Planteamos la hipótesis de que, en combinación, estos factores convierten a la población humana en una incubadora de estrés e inflamación, acompañada de disfunción cognitiva y conductual y, en consecuencia, conflicto. El conflicto y la competencia sobrecargan aún más la tolerancia al estrés de los individuos, volviéndolos potencialmente menos racionales y más volátiles. Las disparidades en las condiciones generales —sociales y ambientales— y en los determinantes sociales de la salud amplifican estos factores estresantes ( 18 , 19 ) y agravan aún más el conflicto. Dicha volatilidad entre los individuos inflama aún más el cuerpo político, desencadenando un ciclo de retroalimentación positiva que se autoperpetúa y potencia el estrés.
Una consideración final es que la eliminación de oportunidades funcionales para expresar tendencias nativas (para células, individuos o poblaciones) podría invitar a expresiones disfuncionales de las mismas tendencias. Por ejemplo, se ha argumentado que la erradicación de varios parásitos de poblaciones selectas ha resultado en aumentos dramáticos en enfermedades autoinmunes ( 127 ). Si una erradicación análoga del esfuerzo físico de la experiencia moderna de supervivencia ha contribuido a disfunciones hostiles es una cuestión de conjetura. Las tensiones culturales relacionadas con los métodos modernos de vigilancia sugieren que, al igual que con las células, las acciones cultivadas de individuos y grupos pueden ser mal dirigidas de la función a la disfunción con bastante facilidad ( 128 ).
Modelado de la transmisión individual a global del estrés inflamatorio multiescala
Interacciones del modelo
Nuestra hipótesis se basa en la naturaleza entrelazada del estrés, la inflamación y la disfunción neuronal, y la propagación de estos estresores individuales tanto directa como indirectamente dentro de una población para finalmente impactar la función social ( Figura 1 ). Como primer paso, hemos diseñado un modelo matemático de alto nivel que incorpora las siguientes variables clave: estrés ( S ), inflamación ( M ), control neuronal ( C ), curación/restauración de la función ( H ) e intervención ( I ). Notamos que, en la actualidad, el modelo no está calibrado a los datos y se simula utilizando unidades arbitrarias (AU), dado que se necesita la adquisición masiva de datos multiescala y el análisis computacional a través de todos estos procesos para probar estas hipótesis y entender la dinámica compleja subyacente a este sistema de estrés-inflamación. La Figura 2 representa las interacciones básicas entre estas variables, que se traducen al modelo matemático (detallado en el Apéndice ). En particular, este modelo es relevante para dos interpretaciones diferentes de la interacción del estrés y la inflamación: una interpretación individual y una interpretación social. Además, este marco puede explicar tanto el eustrés como el distrés.
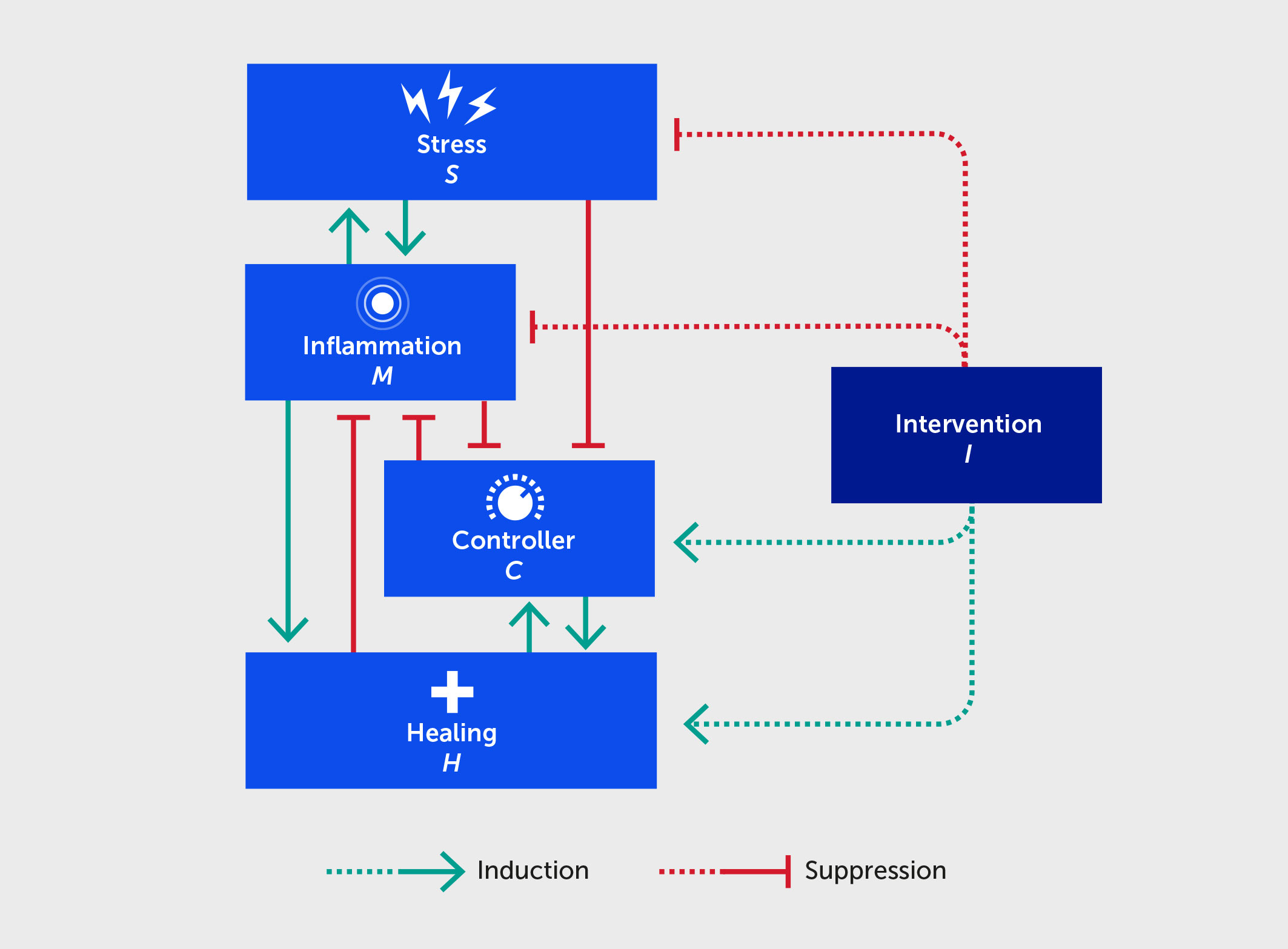 Figura 2. Esquema de un modelo matemático que describe las interacciones entre el estrés (S), la inflamación (M), el controlador (C), la curación (H) y una intervención (I) que beneficia a cada uno de ellos (líneas discontinuas). Las flechas verdes hacia adelante indican la activación o la promoción de una interacción específica, mientras que las flechas rojas romas indican la inhibición.
Figura 2. Esquema de un modelo matemático que describe las interacciones entre el estrés (S), la inflamación (M), el controlador (C), la curación (H) y una intervención (I) que beneficia a cada uno de ellos (líneas discontinuas). Las flechas verdes hacia adelante indican la activación o la promoción de una interacción específica, mientras que las flechas rojas romas indican la inhibición.
La variable de estrés puede comprender un número ilimitado de estresores internos y externos en el sistema. Por ejemplo, los estresores internos podrían incluir una dieta poco saludable, inactividad física (es decir, estilo de vida sedentario), deficiencia de sueño, adicciones, enfermedades crónicas, disbiosis y afecciones de salud mental (p. ej., depresión, ansiedad y medicamentos asociados), o una falta de psicología positiva/conexión social (es decir, aislamiento social) ( 44 ). Los estresores externos podrían incluir infecciones microbianas, factores climáticos y ambientales naturales, agitación política, hacinamiento, estatus socioeconómico, interacciones sociales directas y digitales u otras fuentes de estrés digital (p. ej., feeds de redes sociales constantes y de fácil acceso y el ciclo de noticias). El modelo permite cualquier combinación de dichas entradas de estrés y su ponderación de acuerdo con datos empíricos.
En el modelo, la exposición a factores estresantes desencadena un grado variable de respuesta inflamatoria. A nivel individual, un aumento en la respuesta inflamatoria del cuerpo causa más estrés en el cuerpo, produciendo un ciclo autosostenido de estrés → inflamación → estrés (es decir, llevando a distrés ). Aplicando una interpretación social, los factores estresantes sociales desencadenan inquietud que lleva a un estado de alarma y pánico (es decir, «estado inflamado» de una población) donde las reglas sociales no se obedecen. Además, argumentaríamos que la inflamación social causa un mayor estrés ambiental porque los humanos estresados, inflamados y, en consecuencia, con deterioro cognitivo son más propensos a tomar decisiones dañinas que contribuyen a la degradación ambiental, produciendo un ciclo de estrés e inflamación autosostenido similar al generado a nivel individual.
Dado que el SNC regula parcialmente la respuesta inflamatoria, la variable controladora en el modelo se concibe como control neuronal a nivel individual. A nivel social, el controlador es un proxy de las normas sociales adquiridas y las organizaciones y otros mecanismos que sustentan estas normas. El controlador trabaja para reducir y prevenir un estado inflamatorio abrumador abstraído a nivel de toda la persona, al igual que las normas adquiridas ayudan a reducir el malestar social ( Figura 2 ). Un estado altamente inflamado degrada la capacidad del SNC para regular aún más el estrés y la inflamación, al igual que el malestar ciudadano conduce a acciones que degradan la adherencia a las normas, reglas y leyes sociales. La inflamación promueve la curación en el modelo, ya que el propósito principal de la inflamación es curar el cuerpo (p. ej., de una infección) y restablecer la estabilidad que está dentro de los límites alostáticos. El proceso de curación proporciona retroalimentación para reducir la inflamación. La variable de curación en el modelo puede interpretarse como una medida de desviación del equilibrio homeostático. A nivel individual, la variable de curación en el modelo está vinculada al nivel de daño o DAMP en el sistema; a nivel social, a medida que resurge la estabilidad, la variable de curación podría estar vinculada a la relajación o eliminación de leyes y regulaciones establecidas para abordar el desorden social.
Finalmente, el modelo también puede considerar los efectos de intervenciones externas que inhiben el estrés y la inflamación, promueven la curación y restablecen el control en un rango saludable y sostenible. Por ejemplo, estas podrían incluir cambios en la dieta, el ejercicio, el sueño o la medicación a nivel individual, así como tendencias sociales, subsidios gubernamentales y normas a nivel social.
Simulaciones de modelos: transmisión, control e intervención del estrés
Al evaluar los resultados de todas las simulaciones del modelo, comparar los niveles de estado estacionario de estrés, inflamación, controlador y curación con sus respectivos niveles basales (azul oscuro) en el tiempo 0 permitirá comprender si el estrés añadido al sistema causa resultados perjudiciales (p. ej., inflamación descontrolada) o si se restablece el nivel basal, independientemente de todas las variables del modelo simuladas en las UA. Una vez disponible el conjunto de datos, los niveles de mediadores inflamatorios y los biomarcadores de la función neurológica podrían utilizarse para calibrar las condiciones basales iniciales del sistema para un nivel moderado de estrés de entrada; estas variables específicas se representarían en las unidades apropiadas.
Para este ejercicio in silico , el modelo se prueba con seis entradas de factores de estrés abstractos (que podrían corresponder a cualquiera de los factores enumerados anteriormente) que tienen el mismo peso con respecto a su impacto en el sistema general. La simulación del modelo muestra cómo el aumento del estrés incrementa la inflamación al tiempo que perjudica el control neuronal de la inflamación ( Figura 3 ). Cuando todos los factores de entrada de estrés se establecen en su nivel de referencia ( f i = 0,5), se considera que el sistema está en un estado basal con niveles moderados de estrés e inflamación (véanse las curvas de color azul oscuro; las unidades son arbitrarias). La Figura 3 simula los límites superior e inferior de las seis entradas de estrés: las curvas rojas corresponden a todo el estrés alto ( todo f i = 1) y las curvas verde azulado a bajo estrés (todo f i = 0). Aquí, el sistema se simula en ausencia de cualquier intervención.
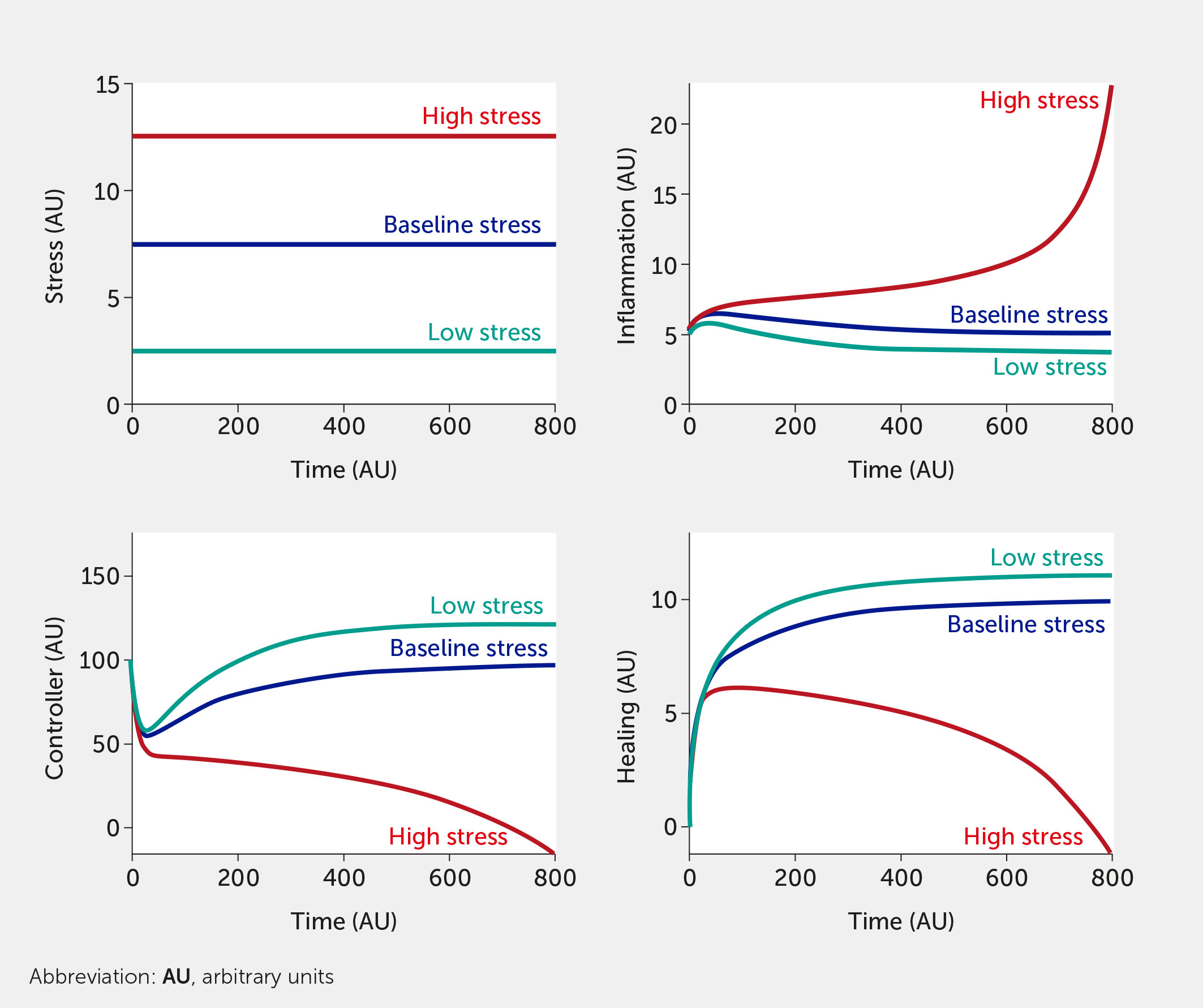 Figura 3 Predicciones del modelo para los niveles de estrés, inflamación, controlador y curación en función del tiempo dados seis entradas de factores de estrés igualmente ponderadas de estrés bajo (todos f i = 0, verde azulado), basal (todos f i = 0,5, azul oscuro) o alto (todos f i = 1, rojo) en ausencia de intervención (es decir, I = 0 en todas las ecuaciones del modelo).
Figura 3 Predicciones del modelo para los niveles de estrés, inflamación, controlador y curación en función del tiempo dados seis entradas de factores de estrés igualmente ponderadas de estrés bajo (todos f i = 0, verde azulado), basal (todos f i = 0,5, azul oscuro) o alto (todos f i = 1, rojo) en ausencia de intervención (es decir, I = 0 en todas las ecuaciones del modelo).
También se pueden simular combinaciones de diversos grados de factores de estrés. Por ejemplo, una entrada de f 1 = 1, con todos los demás factores f 2 = f 3 = f 4 = f 5 = f 6 = 0,5, mostraría un aumento sustancial del estrés y la inflamación en el sistema (en comparación con el valor inicial), lo que ilustra cómo un solo componente del estrés en el estilo de vida podría causar daños graves al cuerpo. Sin embargo, el modelo se basa actualmente en el supuesto de que un estrés elevado en un aspecto del estilo de vida o un estrés moderado en múltiples áreas producirá una respuesta inflamatoria similar. Este resultado del modelo podría utilizarse para demostrar por qué los hábitos de dieta y sueño que se perciben como relativamente inofensivos podrían, de hecho, ser muy perjudiciales para un individuo (o comunidad) en un estado de alta inflamación, ya que estos factores interactúan sinérgicamente para inducir altos niveles de estrés.
Fundamentalmente, este marco de modelado es escalable desde el individuo hasta la población. En la Figura 4 , el modelo se utiliza para simular el efecto del estrés transmitido por otros. El eje vertical traza el nivel de estrés de un individuo (aquí varía de 0 a 10); el eje horizontal muestra una entrada de modelo adicional correspondiente al estrés transmitido a un individuo por otros. Dado que esta es una entrada de estrés del modelo, varía de 0 a 1: 0 corresponde a la ausencia de transmisión de estrés (mostrada como la región a la izquierda de las líneas punteadas) y 1 denota el mayor nivel de estrés que puede ser inducido por una población. En la Figura 4A , el estrés total en el sistema se indica mediante el mapa de colores, donde el rojo indica los niveles de estrés más altos. El mapa de colores en la Figura 4B muestra el nivel de función del controlador en el sistema; como se esperaba, las regiones de alto estrés conducen a regiones de disfunción del controlador.
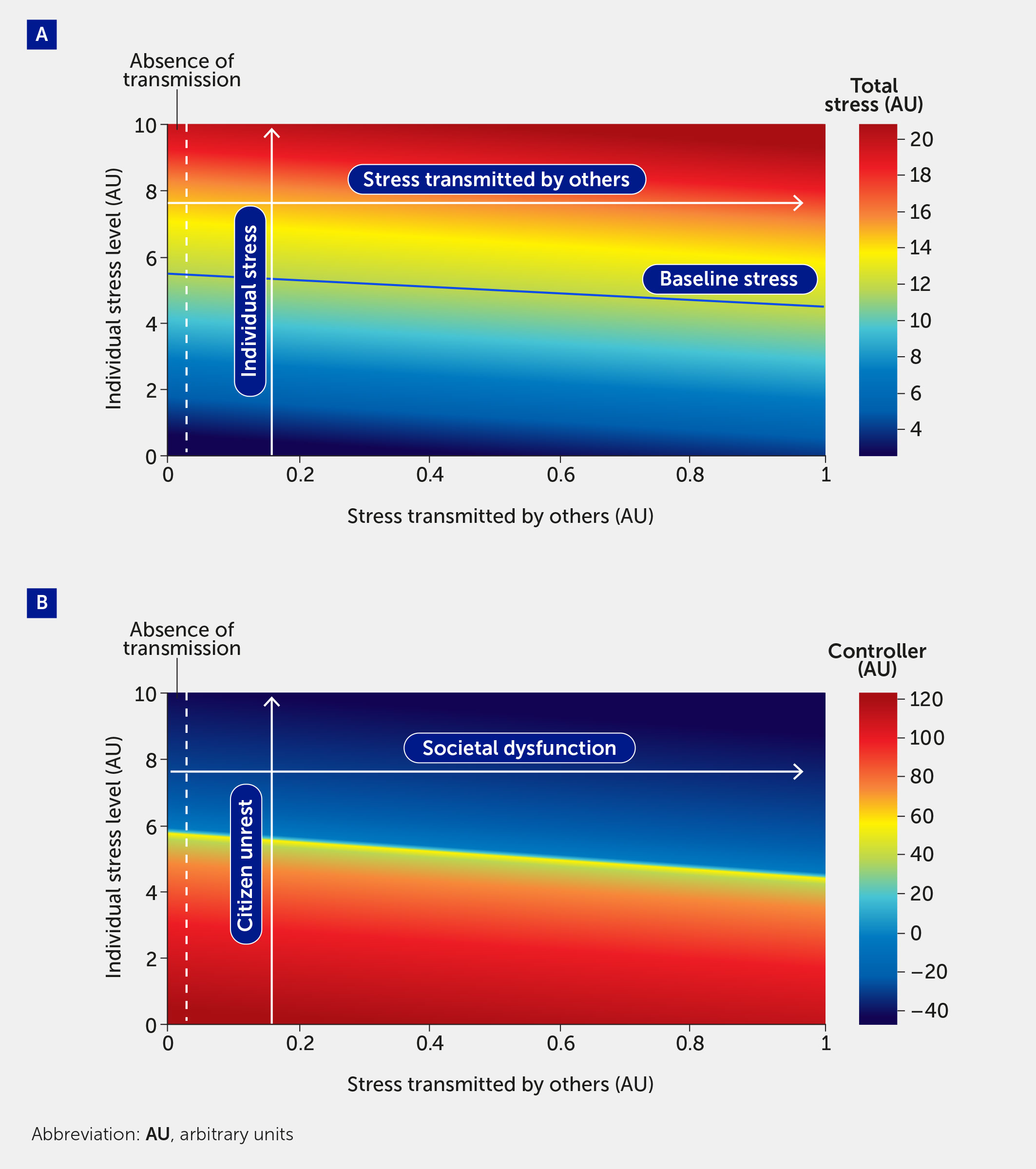 Figura 4 El impacto del estrés transmitido por otros se cuantifica por el estrés total experimentado por un individuo (A) y la función del controlador (B) . A medida que el estrés total (A) aumenta (región roja), la función del controlador (B) disminuye (región azul). Las regiones a la izquierda de la línea discontinua vertical indican los niveles de estrés y controlador que siente un individuo en ausencia de estrés transmitido a ese individuo por otros. Se proporciona un nivel de referencia de estrés (línea azul sólida), que corresponde a todas las entradas de estrés f i = 0,5, para comparación. Las etiquetas en el panel B proporcionan la interpretación social del impacto del estrés transmitido por otros. Específicamente, un aumento en el «nivel de estrés individual» corresponde a un mayor nivel de malestar ciudadano, y un mayor nivel de «estrés transmitido por otros» corresponde a una mayor disfunción social.
Figura 4 El impacto del estrés transmitido por otros se cuantifica por el estrés total experimentado por un individuo (A) y la función del controlador (B) . A medida que el estrés total (A) aumenta (región roja), la función del controlador (B) disminuye (región azul). Las regiones a la izquierda de la línea discontinua vertical indican los niveles de estrés y controlador que siente un individuo en ausencia de estrés transmitido a ese individuo por otros. Se proporciona un nivel de referencia de estrés (línea azul sólida), que corresponde a todas las entradas de estrés f i = 0,5, para comparación. Las etiquetas en el panel B proporcionan la interpretación social del impacto del estrés transmitido por otros. Específicamente, un aumento en el «nivel de estrés individual» corresponde a un mayor nivel de malestar ciudadano, y un mayor nivel de «estrés transmitido por otros» corresponde a una mayor disfunción social.
Una característica emergente de este modelo es que el controlador, que actúa para estabilizar al individuo y a la población, puede transitar a un estado en el que no solo es incapaz de gestionar el estrés, sino que, de hecho, impulsa la disfunción. Interpretamos los valores negativos de la función del controlador como indicadores de un escenario en el que el controlador está provocando una desregulación del sistema, que se manifestaría en una toma de decisiones perjudicial. El límite de la región azul en la Figura 4B corresponde al punto de inflexión de la disfunción social reversible a la irreversible. A partir de aquí, el modelo puede utilizarse para estimar el número de individuos necesario para provocar el colapso de un sistema.
El marco de modelado también puede evaluar el impacto potencial de las intervenciones. Actualmente, la intervención (variable “ I ”) se modela de una manera que inhibe el estrés y la inflamación y promueve la función controladora y curativa. Este formalismo se eligió para probar el amplio impacto de las intervenciones, pero prevemos modificarlo para que una intervención específica solo altere una función (p. ej., solo el controlador versus solo la respuesta inflamatoria). Se introducen dos intervenciones diferentes a nivel individual en la Figura 5 y la Figura 6. En la Figura 5 , una intervención de estilo de vida, p. ej., hacer ejercicio moderado/vigorosamente algunos días a la semana ( 44 , 129 ) o terapias cognitivo-conductuales ( 24 , 44 ), que se sabe que reducen la mortalidad en grandes estudios epidemiológicos ( 130 ), se incluye asumiendo que su eficacia es de aproximadamente el 30%. La Figura 6 simula una intervención farmacológica médica que se asume como 100% efectiva (una clara sobreestimación utilizada simplemente para probar el modelo) con un inicio del beneficio terapéutico observado poco tiempo después de la administración, lo cual sería consistente con el tiempo necesario para que un fármaco antidepresivo surta efecto completo ( 131 , 132 ); otros tipos de fármacos (o dispositivos) relevantes también podrían modelarse con diferencias en la cinética. En estas simulaciones, el fármaco tiene un efecto más rápido y mayor que la intervención individual en el estilo de vida y muestra un beneficio particularmente mayor en niveles basales de estrés altos. Sin embargo, esta brecha es probablemente demasiado estrecha si se asume una eficacia del fármaco mucho menor (y más realista).
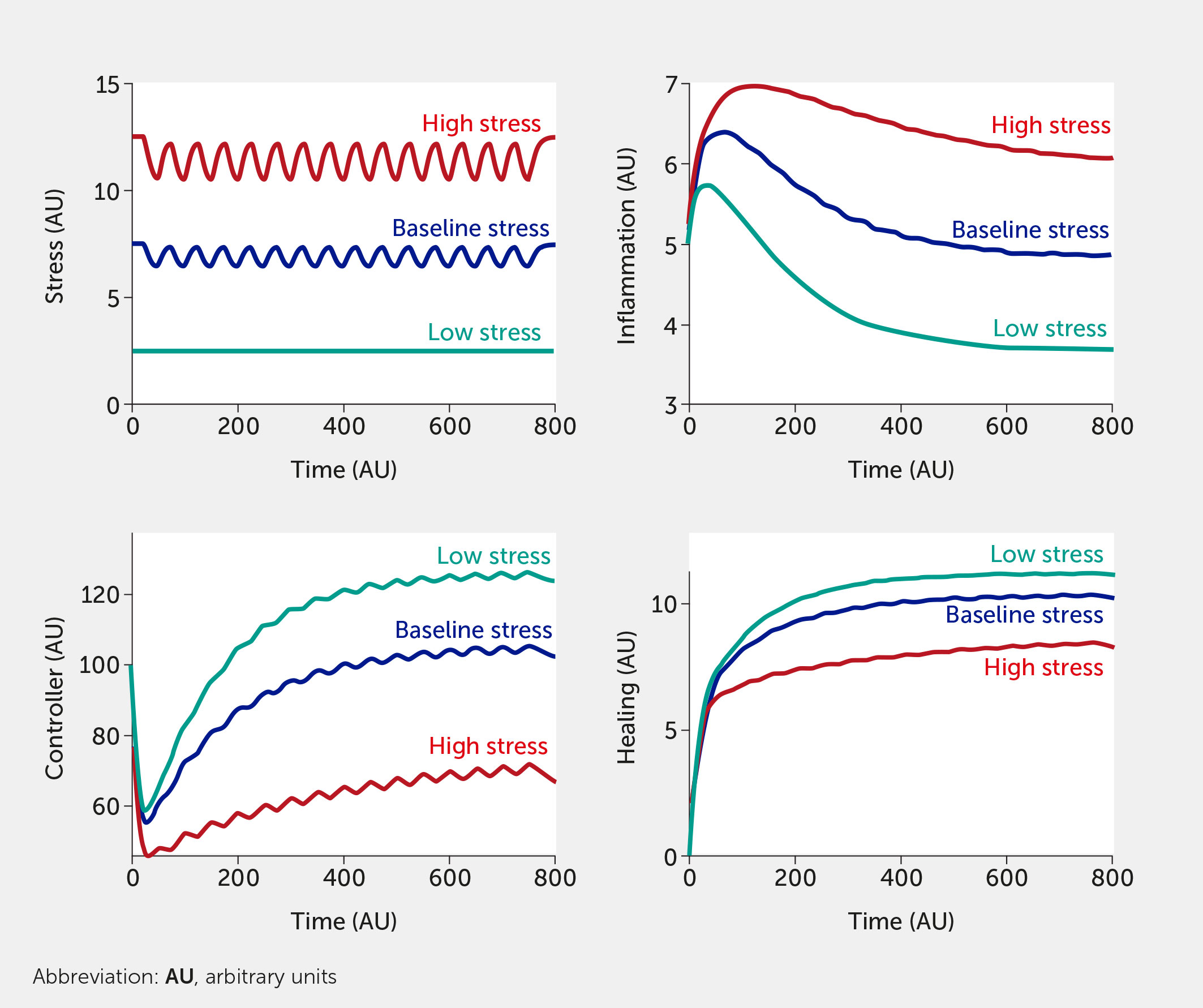 Figura 5 Predicciones del modelo para los niveles de estrés, inflamación, controlador y curación en función del tiempo dadas entradas de estrés bajo (todos f i = 0, verde azulado), basal (todos f i = 0,5, azul oscuro) o alto (todos f i = 1, rojo) en presencia de una intervención periódica con 30 % de eficacia (por ejemplo, ejercicio).
Figura 5 Predicciones del modelo para los niveles de estrés, inflamación, controlador y curación en función del tiempo dadas entradas de estrés bajo (todos f i = 0, verde azulado), basal (todos f i = 0,5, azul oscuro) o alto (todos f i = 1, rojo) en presencia de una intervención periódica con 30 % de eficacia (por ejemplo, ejercicio).
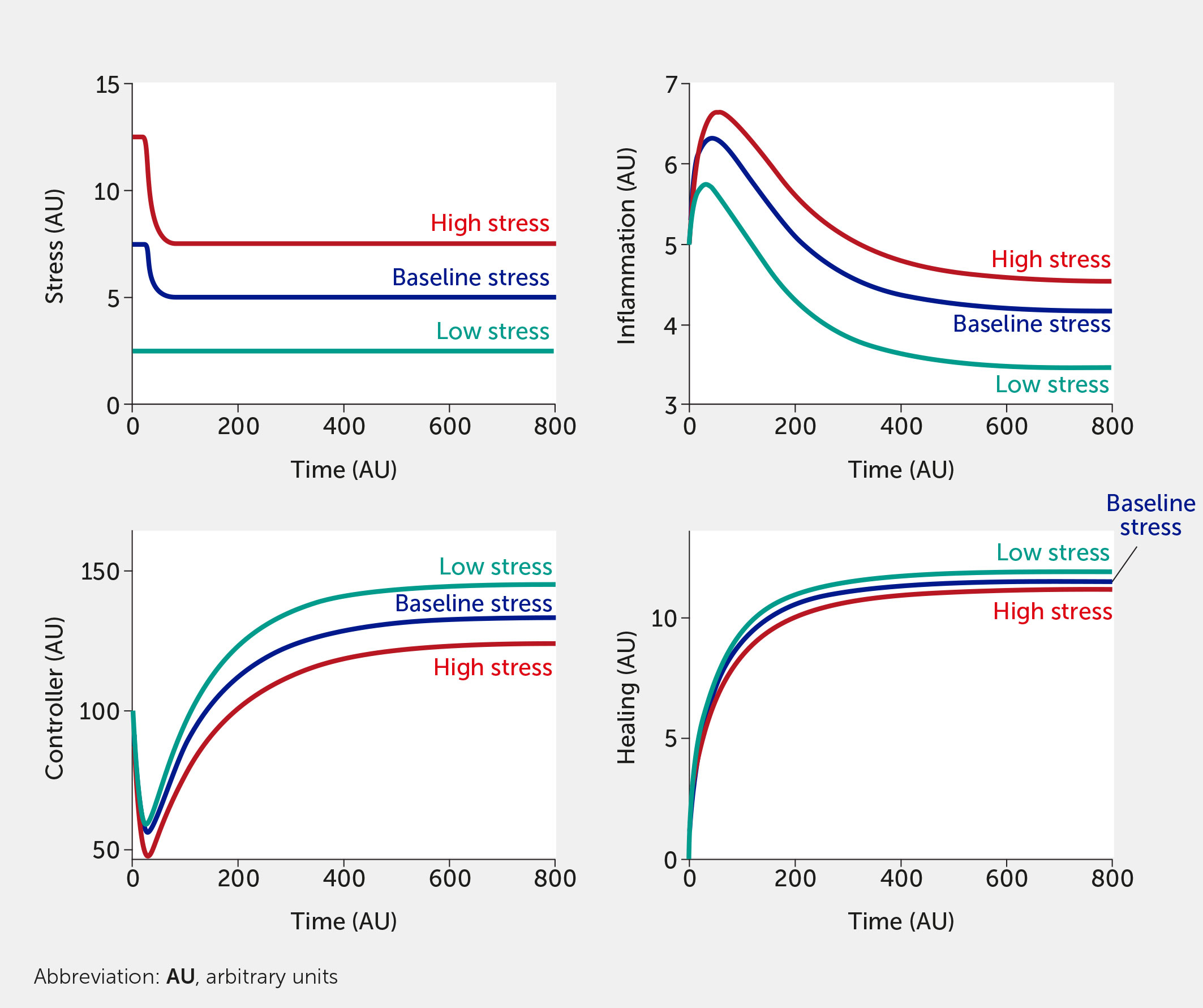 Figura 6 Predicciones del modelo para los niveles de estrés, inflamación, controlador y curación en función del tiempo dadas entradas de estrés bajo (todos f i = 0, verde azulado), basal (todos f i = 0,5, azul oscuro) o alto (todos f i = 1, rojo) en presencia de una intervención sostenida con 100 % de eficacia (por ejemplo, medicación) iniciada en el tiempo = 25.
Figura 6 Predicciones del modelo para los niveles de estrés, inflamación, controlador y curación en función del tiempo dadas entradas de estrés bajo (todos f i = 0, verde azulado), basal (todos f i = 0,5, azul oscuro) o alto (todos f i = 1, rojo) en presencia de una intervención sostenida con 100 % de eficacia (por ejemplo, medicación) iniciada en el tiempo = 25.
El concepto de resiliencia es inherente a nuestro modelo. La Figura 7 muestra el impacto de aumentar ligeramente el parámetro de resiliencia, S crit , en ausencia de intervención. Los resultados del modelo se muestran para condiciones de alto estrés, aunque el efecto de aumentar S crit es evidente en cualquier nivel de estrés. Aumentar el umbral de resiliencia de un valor inicial arbitrario de 6 a 7 redujo la respuesta del sistema de un nivel extremadamente alto de inflamación a un nivel mucho más bajo (ligeramente superior al valor basal), a la vez que mejoró la función controladora y la curación. Este aumento del umbral corresponde a un individuo o sociedad con la resiliencia suficiente para soportar un mayor nivel de estrés.
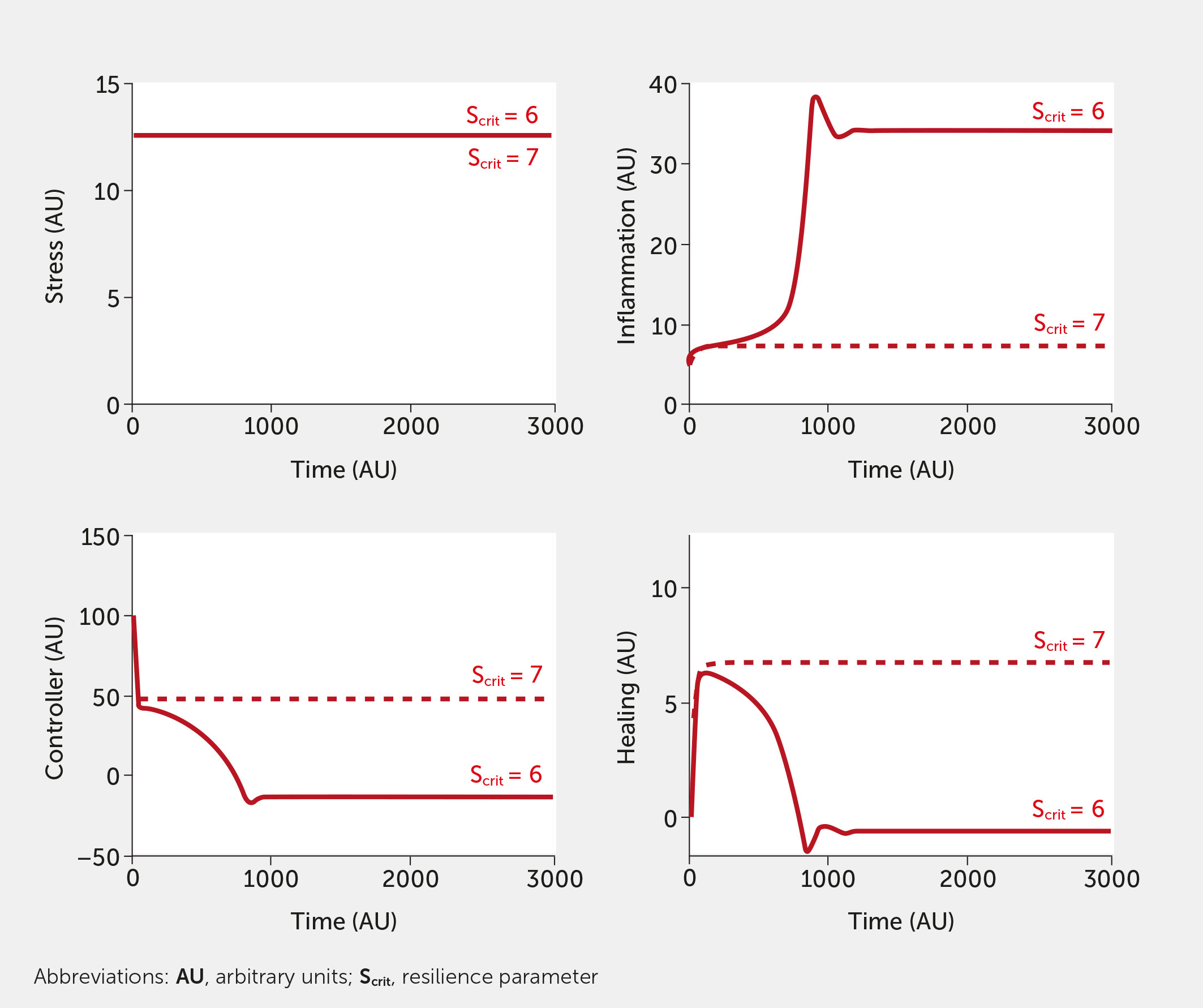 Figura 7. Impacto del parámetro de resiliencia (S crit ). Predicciones del modelo para los niveles de estrés, inflamación, controlador y curación en función del tiempo, dadas las entradas de alto estrés (todos f i = 1, rojo) en ausencia de intervención para un nivel basal (S crit = 6, sólido) y elevado (S crit = 7, discontinuo) de S crit .
Figura 7. Impacto del parámetro de resiliencia (S crit ). Predicciones del modelo para los niveles de estrés, inflamación, controlador y curación en función del tiempo, dadas las entradas de alto estrés (todos f i = 1, rojo) en ausencia de intervención para un nivel basal (S crit = 6, sólido) y elevado (S crit = 7, discontinuo) de S crit .
El modelo pretende ilustrar la compleja relación entre diversos factores endógenos y exógenos implicados en el estrés y la inflamación, así como su propagación en individuos y colectivos. Su objetivo es demostrar que el uso de un enfoque de modelado puede ayudarnos a analizar, monitorear y predecir el impacto de las intervenciones en los individuos y la población en general. Dada la urgente necesidad de comprender mejor la naturaleza multiescalar del estrés y la inflamación, debido a su gran impacto en la sociedad, argumentamos que estos modelos deben formar parte de las herramientas de control del estrés y la inflamación para fundamentar la toma de decisiones colectiva racional.
Conclusión: un enfoque multicapa y multiescalar para mitigar el estrés inflamatorio global
Hemos argumentado a favor de las implicaciones fisiopatológicas y cognitivas globales del estrés generalizado y abrumador, a la vez que sugerimos cómo unos niveles de estrés más bajos podrían mejorar la resiliencia. En particular, la comunidad científica ha comenzado a reconocer la naturaleza de «policrisis» de los estresores entrelazados que hemos descrito aquí, pero las soluciones propuestas se centran en intervenciones farmacológicas reduccionistas tradicionales ( 133 ). En contraste, el modelo que proponemos, por su propia naturaleza, se manifiesta y se regula a múltiples escalas. Por lo tanto, el desafío radica en estructurar (y personalizar, para el individuo y la sociedad) un conjunto proporcional de intervenciones multiescala para mitigar los efectos nocivos del distrés, al tiempo que se reconoce el valor del eustrés . Para identificar y validar dichas intervenciones multiescala, buscamos aprovechar el poder del modelado matemático: nuestro ejemplo aquí, vincular el estrés, la inflamación y la cognición, puede revelar explicaciones potencialmente no intuitivas para el comportamiento y las relaciones entre células, organismos y superorganismos (es decir, comunidades de organismos), como la interacción de múltiples estresores individuales que pueden conducir a un ciclo de retroalimentación directa, proinflamatorio y prácticamente irrecuperable. Somos conscientes de que el campo del modelado matemático es maduro y ha evolucionado en muchos dominios. Sin embargo, hasta ahora, estos efectos multiescala han sido demasiado complejos para dominarlos por completo y representan un desafío para el campo. Claramente, se necesita mucho más trabajo para avanzar en los modelos de estrés e inflamación multiescala, validarlos y obtener consenso sobre sus suposiciones subyacentes; para incorporar factores/variables adicionales que actualmente son solo implícitos, por ejemplo, factores como los ritmos circadianos, cuyos impactos multifacéticos se han modelado matemáticamente ( 134 ); para obtener datos para verificar y validar los supuestos cualitativos centrales de este modelo tanto a nivel individual como poblacional; y hacer el modelo más cuantitativo mediante la obtención de datos prospectivos en estudios a gran escala. Se han publicado esfuerzos tempranos y alentadores en este sentido, en los que conjuntos de datos agregados han respaldado una imagen de la disfunción inmunitaria relacionada con el estrés en el contexto de la desventaja socioeconómica ( 135 ). Además, se deben explorar simultáneamente otros formalismos de modelado (p. ej., aprendizaje automático, una vez que se obtienen datos suficientes). Este proceso multifacético requeriría un esfuerzo internacional coordinado e interdisciplinario que involucre a las partes interesadas clave, y esperamos que este artículo estimule a la comunidad investigadora en general a brindar aportes al respecto.
El objetivo de este esfuerzo a gran escala sería definir intervenciones que mejorarían las vidas de las personas y la resiliencia de las comunidades al estrés. Los conocimientos clave del modelado de la inflamación inducida por el estrés y su impacto en la función cognitiva/ejecutiva a nivel individual, y la extrapolación de estos conocimientos al nivel de la sociedad, sugieren la necesidad de intervenciones multiescala para mitigar los efectos perjudiciales del estrés. Esta es una observación importante porque implica que, para controlar el estrés y la inflamación, las intervenciones unitarias que se dirigen a un solo nivel de esta etiología multiescala no serán suficientes e incluso pueden agravar el problema de control. Como ejemplo, podemos considerar la sintomatología aparentemente paradójica de la sepsis, que a primera vista parece desestructurada e incontrolable. Estudios de simulación recientes ( 136–138 ) y estudios in vivo basados en biología sintética ( 139 ) plantean la posibilidad de un control racional basado en modelos de este síndrome aparentemente intratable. En este contexto, la mitigación del estrés significa atenuar la retroalimentación positiva dentro y entre capas. El modelo matemático inicial presentado aquí puede usarse para describir las condiciones de estrés bajo las cuales el controlador restablecerá exitosamente la homeostasis, en comparación con un colapso del sistema bajo niveles sorprendentemente altos de inflamación. Las intervenciones pueden evaluarse para determinar el momento óptimo de la dosis y la eficacia necesaria para restaurar la inflamación a los niveles basales y qué vías deben abordarse para obtener la mayor mejoría. Sugerimos que, a nivel individual, los medicamentos antiinflamatorios no son la respuesta, o al menos no toda la respuesta, porque reducen la inflamación indiscriminadamente y, por lo tanto, pueden mitigar los efectos beneficiosos del eustrés. En cambio, sugerimos (como era de esperar) que mejorar el estilo de vida (nutrición, sueño, ejercicio, etc.) sería beneficioso ( 44 ), como lo sería, por supuesto, reducir la exposición al estrés ( 140 ), lo que correspondería a una disminución de los valores de f i en el modelo. También puede haber un papel para las intervenciones «nutracéuticas», como los probióticos, para modular el microbioma ( 141 ). Con base en la evidencia correlativa citada anteriormente y nuestras simulaciones de modelos, sugerimos que un aspecto clave para aliviar el estrés consiste en reducir el número, la frecuencia y la duración de las interacciones o eventos estresantes (p. ej., reducir el uso de las redes sociales) y crear más espacio para el individuo, tanto literal como figurativamente. Las modificaciones del entorno físico/construido para proporcionar más áreas con un ambiente tranquilo también probablemente sean beneficiosas ( 142).Nuestro marco conceptual también plantea la cuestión de cómo responder al estrés y la inflamación digitales causados por el libre mercado del «capitalismo de vigilancia» ( 23 ). En este caso, una respuesta podría ser fomentar la resiliencia mediante la educación continua de la ciudadanía sobre las narrativas maestras que sustentan nuestras sociedades, sus normas y valores ( 143 ).
Con respecto a la terapéutica, sugerimos la necesidad de identificar fármacos que combatan afecciones como la depresión mediante la modulación de las respuestas inflamatorias asociadas ( 144 ) o fármacos que antagonicen las vías que mantienen la inflamación, p. ej., fármacos dirigidos a las respuestas inmunitarias de tipo 17 ( 145 , 146 ). La neuromodulación es otra área clave que debe explorarse, ya que puede mejorar la función del controlador y reducir la inflamación ( 147 ). Finalmente, como la evidencia sugiere que el estrés proinflamatorio podría estar impreso epigenéticamente y ser potencialmente hereditario ( 148 ), el impacto transgeneracional a largo plazo de estos mecanismos (y terapias) justifica una mayor investigación.
Aunque vacilante y desigual desde una perspectiva global, está en marcha un cambio de paradigma de la medicina reactiva y reductiva a la medicina personalizada, predictiva y proactiva basada en un amplio perfil molecular combinado con bioinformática y modelado computacional ( 149 , 150 ). Esta transición es especialmente importante en el contexto de la medicina del estilo de vida, donde los pacientes, los médicos y las instituciones podrían aprovechar las tecnologías emergentes para abordar la inflamación crónica de una manera altamente personalizada ( 44 ). Un ejemplo temprano y exitoso de esta transición es la aplicación de enfoques individualizados de salud cerebral digital en la rehabilitación de accidentes cerebrovasculares derivados de marcos teóricos y de modelado avanzados ( 151 ). Como se sugirió anteriormente ( 152 ) y se demostró aquí, se pueden utilizar herramientas como el modelado matemático mecanicista para describir, reproducir y predecir interacciones complejas que involucran estrés, resiliencia, inflamación y estilo de vida.
Este trabajo también puede servir para impulsar debates más teóricos o filosóficos. A riesgo de caer en el antropomorfismo, se puede argumentar que este paradigma puede extenderse aún más hacia afuera, a un nivel global, en el que las acciones colectivas de los humanos son el estrés en esta «era del Antropoceno», y el planeta muestra una respuesta inflamatoria en forma de calentamiento global y cambio climático asociado ( 153 ). Queda por determinar si esto es una manifestación de inflamación disfuncional o de autodefensa efectiva y podría ser una cuestión de perspectiva, ya que los intereses de la vida planetaria en general y los de nuestra especie potencialmente divergen. Sin embargo, nuestro modelo propone que la población humana y sus artefactos también pueden verse como un sustrato de inflamación y estrés, amenazando potencialmente la coexistencia estable con el planeta en general. Claramente, esta es una hipótesis muy especulativa, de orientación filosófica. En conjunto, esperamos que el paradigma y el modelo presentados aquí impulsen un mayor diálogo, debate e investigación sobre los posibles mecanismos que vinculan el estrés, la inflamación y la cognición desde el nivel personal al global.
Material complementario
El material complementario de este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fsci.2023.1239462/full#supplementary-material
Declaraciones
Contribuciones del autor
YV: Redacción del borrador original, Redacción, revisión y edición, Conceptualización, Investigación, Metodología, Administración del proyecto, Supervisión, Visualización. JA: Redacción del borrador original, Redacción, revisión y edición, Conceptualización, Análisis formal, Obtención de financiación, Investigación, Metodología, Recursos, Software, Visualización. PFMJV: Redacción del borrador original, Redacción, revisión y edición, Conceptualización, Investigación. DLK: Redacción del borrador original, Redacción, revisión y edición, Conceptualización, Investigación.
Todos los autores contribuyeron por igual.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material suplementario. Para más información, contacte con el autor correspondiente.
Fondos
YV recibió el apoyo de las siguientes subvenciones/contratos: Agencia de Proyectos de Investigación Avanzada de Defensa de EE. UU. (D20AC00002); Departamento de Defensa de EE. UU. (W81XWH-18-2-0051, W81 XWH-15-1-0336 y W81XWH-15-PRORP-OCRCA); y NIH U01EB021960-01A1, RO1-GM107231, R01CA214865, UO1-DK072146 y P50-GM-53789. JA agradece a NSF DMS-1654019, NSF DMS-1852146 y NIH R01EY030851. PFMJV cuenta con el apoyo de la Comisión Europea a través de AISN (HE, 101057655), EBRAINS-HEALTH (HE, 101058516), PHRASE (EIC, 101058240), NEST (AAL-2020-7-227-CP).
Incompatibilidad
YV es cofundador y accionista de Immunetrics, Inc., y consultor de Anuna AI. PFMJV es fundador y accionista de Eodyne Systems sl y Sapiens5 Holding BV. DLK trabajó para Tangelo – Intend, Inc. Ni estas empresas ni los financiadores mencionados participaron en el diseño del estudio, la recopilación, el análisis y la interpretación de los datos, la redacción de este artículo ni en la decisión de enviarlo para su publicación. Las empresas mencionadas tampoco financiaron el estudio.
El autor restante declara que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Los autores YV y PV declararon ser miembros del consejo editorial de Frontiers al momento de la presentación. Esto no influyó en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son exclusivamente de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las de la editorial, los editores ni los revisores. Ningún producto evaluado en este artículo, ni ninguna afirmación realizada por su fabricante, está garantizada ni respaldada por la editorial.
Referencias
1. Coussens LM, Werb Z. Inflamación y cáncer. Nature (2002) 420(6917):860–7. doi: 10.1038/nature01322
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Medzhitov R. Origen y funciones fisiológicas de la inflamación. Nature (2008) 454(7203):428–35. doi: 10.1038/nature07201
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Moseley P. Proteínas de estrés y respuesta inmunitaria. Inmunofarmacología (2000) 48(3):299–302. doi: 10.1016/s0162-3109(00)00227-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Gallucci S, Matzinger P. Señales de peligro: Un llamado de atención al sistema inmunitario. Curr Opin Immunol (2001) 13(1):114–9. doi: 10.1016/s0952-7915(00)00191-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Nathan C, Ding A. Inflamación no resolutiva. Cell (2010) 140(6):871–82. doi: 10.1016/j.cell.2010.02.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Dick TE, Molkov Y, Nieman G, Hsieh Y, Jacono FJ, Doyle J, et al. Vinculación de la inflamación y la variabilidad cardiorrespiratoria en la sepsis mediante modelado computacional. Front Physiol (2012) 3:222. doi: 10.3389/fphys.2012.00222
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Colaboradores del GBD 2019 sobre Enfermedades y Lesiones. Carga mundial de 369 enfermedades y lesiones en 204 países y territorios, 1990-2019: un análisis sistemático para el Estudio de la Carga Mundial de Enfermedades 2019. Lancet (2020) 396(10258):1204–22. doi: 10.1016/S0140-6736(20)30925-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Asociación Americana de Psicología. Estrés en Estados Unidos 2022: Preocupados por el futuro, acosados por la inflación . Washington, D. C.: Asociación Americana de Psicología (2022). Disponible en: https://www.apa.org/news/press/releases/stress/2022/concerned-future-inflation .
10. Daniali H, Martinussen M, Flaten MA. Un metaanálisis global de la depresión, la ansiedad y el estrés antes y durante la COVID-19. Health Psychol (2023) 42(2):124–38. doi: 10.1037/hea0001259
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Nochaiwong S, Ruengorn C, Thavorn K, Hutton B, Awiphan R, Phosuya C, et al. Prevalencia global de problemas de salud mental en la población general durante la pandemia de la enfermedad por coronavirus de 2019: una revisión sistemática y un metanálisis. Sci Rep (2021) 11(1):10173. doi: 10.1038/s41598-021-89700-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Logan AC, Prescott SL, Haahtela T, Katz DL. La importancia del exposoma y la carga alostática en el paradigma de la salud planetaria. J Physiol Anthropol (2018) 37(1):15. doi: 10.1186/s40101-018-0176-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Levy BS, Patz JA. Cambio climático, derechos humanos y justicia social. Ann Glob Salud (2015) 81(3):310–22. doi: 10.1016/j.aogh.2015.08.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Koenen KC, Ratanatharathorn A, Ng L, McLaughlin KA, Bromet EJ, Stein DJ, et al. Trastorno de estrés postraumático en las Encuestas Mundiales de Salud Mental. Psychol Med (2017) 47(13):2260–74. doi: 10.1017/S0033291717000708
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Hossain MM, Tasnim S, Sultana A, Faizah F, Mazumder H, Zou L, et al. Epidemiología de los problemas de salud mental en la COVID-19: una revisión. F1000Res (2020) 9:636. doi: 10.12688/f1000research.24457.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Santomauro DF, Mantilla Herrera AM, Shadid J, Zheng P, Ashbaugh C, Pigott DM, et al. Prevalencia y carga global de trastornos depresivos y de ansiedad en 204 países y territorios en 2020 debido a la pandemia de COVID-19. Lancet (2021) 398(10312):1700–12. doi: 10.1016/S0140-6736(21)02143-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Vineis P, Robinson O, Chadeau-Hyam M, Dehghan A, Mudway I, Dagnino S. ¿Qué hay de nuevo en el exposoma? Environ Int (2020) 143:105887. doi: 10.1016/j.envint.2020.105887
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Evans RG, Barer ML, Marmor TR. ¿Por qué algunas personas son sanas y otras no?: los determinantes de la salud de las poblaciones. Edición en formato electrónico . Nueva York: De Gruyter (2021).
19. Castagné R, Delpierre C, Kelly-Irving M, Campanella G, Guida F, Krogh V, et al. Un enfoque del ciclo vital para explorar la inserción biológica de la posición socioeconómica y la movilidad social mediante marcadores inflamatorios circulantes. Sci Rep (2016) 6(1):25170. doi: 10.1038/srep25170
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Hoyer D, Bennett JS, Reddish J, Holder S, Howard R, Benam M, et al. Navegando la policrisis: factores socioculturales a largo plazo que configuran la respuesta al cambio climático. Philos Trans R Soc Lond B Biol Sci (2023) 378(1889):20220402. doi: 10.1098/rstb.2022.0402
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Twenge JM. ¿Por qué el aumento de la depresión adolescente podría estar relacionado con el entorno tecnológico? Curr Opin Psychol (2020) 32:89–94. doi: 10.1016/j.copsyc.2019.06.036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Wolfers LN, Utz S. Uso de redes sociales, estrés y afrontamiento. Curr Opin Psychol (2022) 45:101305. doi: 10.1016/j.copsyc.2022.101305
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Zuboff S. La era del capitalismo de vigilancia: la lucha por un futuro humano en la nueva frontera del poder . Londres: Profile Books (2018).
24. Straub RH, Cutolo M. Psiconeuroinmunología: avances en la investigación del estrés. Wien Med Wochenschr (2018) 168(3–4):76–84. doi: 10.1007/s10354-017-0574-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Chiang JJ, Lam PH, Chen E, Miller GE. Estrés psicológico durante la infancia y la adolescencia y su asociación con la inflamación a lo largo de la vida: una revisión crítica y un metaanálisis. Psychol Bull (2022) 148(1–2):27–66. doi: 10.1037/bul0000351
26. Tracey KJ. El reflejo inflamatorio. Nature (2002) 420(6917):853–9. doi: 10.1038/nature01321
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Zanos TP, Silverman HA, Levy T, Tsaava T, Battinelli E, Lorraine PW, et al. Identificación de señales neuronales sensoriales específicas de citocinas mediante la decodificación de la actividad del nervio vago murino. Proc Natl Acad Sci USA (2018) 115(21):E4843–52. doi: 10.1073/pnas.1719083115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Kressel AM, Tsaava T, Levine YA, Chang EH, Addorisio ME, Chang Q, et al. Identificación de un locus del tronco encefálico que inhibe el factor de necrosis tumoral. Proc Natl Acad Sci USA (2020) 117(47):29803–10. doi: 10.1073/pnas.2008213117
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Bilbo SD, Schwarz JM. Programación temprana del cerebro y la conducta en la edad adulta: un papel crucial para el sistema inmunitario. Front Behav Neurosci (2009) 3:14.2009. doi: 10.3389/neuro.08.014.2009
30. Patterson SL. Desregulación inmunitaria y vulnerabilidad cognitiva en el cerebro envejecido: interacciones de la microglía, IL-1β, BDNF y plasticidad sináptica. Neurofarmacología (2015) 96(A):11–8. doi: 10.1016/j.neuropharm.2014.12.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Borsboom D, Cramer AO. Análisis de redes: un enfoque integrador de la estructura de la psicopatología. Annu Rev Clin Psychol (2013) 9:91–121. doi: 10.1146/annurev-clinpsy-050212–185608
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Verschure PFMJ, Voegtlin T, Douglas RJ. Sinergia mediada por el entorno entre la percepción y el comportamiento en robots móviles. Nature (2003) 425(6958):620–4. doi: 10.1038/nature02024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Seligman ME. Indefensión aprendida. Annu Rev Med (1972) 23:407–12. doi: 10.1146/annuRevme.23.020172.002203
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Farhart C, Miller J, Saunders K. ¿Estrés conspirativo o alivio? Indefensión aprendida y pensamiento conspirativo. En: Barker DC, Suhay E, editores. La política de la verdad en la América polarizada . Oxford: Oxford University Press (2021) 223–56. doi: 10.1093/oso/9780197578384.003.0011
35. Zhou DR, Eid R, Boucher E, Miller KA, Mandato CA, Greenwood MT. El estrés es un agonista en la inducción de la muerte celular programada: una revisión. Biochim Biophys Acta Mol Cell Res (2019) 1866(4):699–712. doi: 10.1016/j.bbamcr.2018.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Nathan C. Puntos de control en la inflamación. Nature (2002) 420(6917):846–52. doi: 10.1038/nature01320
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Nathan C, Sporn M. Citocinas en contexto. J Cell Biol (1991) 113(5):981. doi: 10.1083/jcb.113.5.981
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Medzhitov R, Janeway C Jr. Inmunidad innata. N Engl J Med (2000) 343(5):338–44. doi: 10.1056/NEJM200008033430506
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Andersson U, Tracey KJ. HMGB1 es una diana terapéutica para la inflamación e infección estériles. Annu Rev Immunol. (2011) 29:139–62. doi: 10.1146/annurev-immunol-030409-101323
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Vodovotz Y, Csete M, Bartels J, Chang S, An G. Biología de sistemas traslacional de la inflamación. PloS Comput Biol (2008) 4(4):e1000014. doi: 10.1371/journal.pcbi.1000014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Park C, Rosenblat JD, Brietzke E, Pan Z, Lee Y, Cao B, et al. Estrés, epigenética y depresión: una revisión sistemática. Neurosci Biobehav Rev (2019) 102:139–52. doi: 10.1016/j.neubioRev2019.04.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Kotas ME, Medzhitov R. Homeostasis, inflamación y susceptibilidad a enfermedades. Cell (2015) 160(5):816–27. doi: 10.1016/j.cell.2015.02.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Furman D, Campisi J, Verdin E, Carrera-Bastos P, Targ S, Franceschi C, et al. Inflamación crónica en la etiología de las enfermedades a lo largo de la vida. Nat Med (2019) 25(12):1822–32. doi: 10.1038/s41591-019-0675-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Vodovotz Y, Barnard N, Hu FB, Jakicic J, Lianov L, Loveland D, et al. Investigación priorizada para la prevención, el tratamiento y la reversión de enfermedades crónicas: recomendaciones de la Cumbre de Investigación en Medicina del Estilo de Vida. Front Med (Lausana) (2020) 7:585744(959). doi: 10.3389/fmed.2020.585744
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Buchman TG. La comunidad del yo. Nature (2002) 420(6912):246–51. doi: 10.1038/nature01260
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Reynoso-García J, Miranda-Santiago AE, Meléndez-Vázquez NM, Acosta-Pagán K, Sánchez-Rosado M, Díaz-Rivera J, et al. Una guía completa de los microbiomas humanos: nichos corporales, transmisión, desarrollo, disbiosis y restauración. Biol del sistema frontal (2022) 2:951403. doi: 10.3389/fsysb.2022.951403
47. Wiers RW, Verschure P. Curando el modelo cerebral roto de la adicción: neurorrehabilitación desde una perspectiva sistémica. Addict Behav (2021) 112:106602. doi: 10.1016/j.addbeh.2020.106602
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Rea IM, Gibson DS, McGilligan V, McNerlan SE, Alexander HD, Ross OA. Edad y enfermedades relacionadas con la edad: papel de los desencadenantes de la inflamación y las citocinas. Front Immunol (2018) 9:586. doi: 10.3389/fimmu.2018.00586
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Franceschi C, Garagnani P, Parini P, Giuliani C, Santoro A. Inflamación: un nuevo punto de vista inmunometabólico para las enfermedades relacionadas con la edad. Nat Rev Endocrinol (2018) 14(10):576–90. doi: 10.1038/s41574-018-0059-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Haigis MC, Yankner BA. La respuesta al estrés en el envejecimiento. Mol Cell (2010) 40(2):333–44. doi: 10.1016/j.molcel.2010.10.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Alverdy J, Stern E. Efecto de la inmunonutrición en las estrategias de virulencia bacteriana. Nutrición (1998) 14(7–8):580–4. doi: 10.1016/s0899-9007(98)00008-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Schulkin J, Sterling P. Alostasis: un modo predictivo de regulación fisiológica centrado en el cerebro. Trends Neurosci (2019) 42(10):740–52. doi: 10.1016/j.tins.2019.07.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Zamora R, Korff S, Mi Q, Barclay D, Yin J, Schimunek L, et al. Análisis computacional de la diafonía inflamatoria dinámica multiorgánica inducida por endotoxinas en ratones. PloS Comput Biol (2018) 6:e100658. doi: 10.1371/journal.pcbi.1006582
54. Shah AM, Zamora R, Korff S, Barclay D, Yin J, El-Dehaibi F, et al. Inferencia de interacciones inmunitarias de tipo 17, dependientes de TLR4 y específicas de tejido, en trauma/choque hemorrágico experimental y reanimación mediante modelado computacional. Front Immunol (2022) 13:908618. doi: 10.3389/fimmu.2022.908618
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Zandalinas SI, Fritschi FB, Mittler R. Calentamiento global, cambio climático y contaminación ambiental: la receta para un desastre de combinación de estrés multifactorial. Trends Plant Sci (2021) 26(6):588–99. doi: 10.1016/j.tplants.2021.02.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Bolger N, DeLongis A, Kessler RC, Wethington E. El contagio del estrés en múltiples roles. JMF (1989) 51(1):175–83. doi: 10.2307/352378
57. Liu CH, Doan SN. Contagio del estrés psicosocial en niños y familias durante la pandemia de COVID-19. Clin Pediatr (Filadelfia) (2020) 59(9–10):853–5. doi: 10.1177/0009922820927044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Calvi E, Quassolo U, Massaia M, Scandurra A, D’Aniello B, D’Amelio P. El aroma de las emociones: Una revisión sistemática de la comunicación química intraespecífica e interespecífica de las emociones en humanos. Brain Behav (2020) 10(5):e01585. doi: 10.1002/brb3.1585
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Vermeulen R, Schymanski EL, Barabási AL, Miller GW. El exposoma y la salud: donde la química se encuentra con la biología. Science (2020) 367(6476):392–6. doi: 10.1126/science.aay3164
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Afifi TD, Zamanzadeh N, Harrison K, Acevedo Callejas M. WIRED: el impacto del uso de medios y tecnología en el estrés (cortisol) y la inflamación (interleucina IL-6) en familias con ritmos de vida acelerados. Comput Hum Behav (2018) 81:265–73. doi: 10.1016/j.chb.2017.12.010
61. Lee DS, Way BM. Uso de redes sociales e inflamación sistémica: el papel moderador de la autoestima. Brain Behav Immun Health (2021) 16:100300. doi: 10.1016/j.bbih.2021.100300
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Willoughby DA, Moore AR, Colville-Nash PR, Gilroy D. Resolución de la inflamación. Int J Immunopharmacol (2000) 22(12):1131–5. doi: 10.1016/s0192-0561(00)00064-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Shah AM, Zamora R, Vodovotz Y. La interleucina-17 como puente espaciotemporal entre la inflamación aguda y la crónica: nuevos hallazgos del modelado computacional. Wires Mech Dis (2023) 15(3):e1599. doi: 10.1002/wsbm.1599
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Cox CE. Inflamación sistémica persistente en enfermedades crónicas críticas. Respir Care (2012) 57(6):859–64; discusión 864. doi: 10.4187/respcare.01719
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Gentile LF, Cuenca AG, Efron PA, Ang D, Bihorac A, McKinley BA, et al. Inflamación persistente e inmunosupresión: un síndrome común y un nuevo horizonte para la atención intensiva quirúrgica. J Trauma Acute Care Surg (2012) 72(6):1491–501. doi: 10.1097/TA.0b013e318256e000
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. An G, Nieman G, Vodovotz Y. Biología computacional y de sistemas en trauma y sepsis: estado actual y perspectivas futuras. Int J Burns Trauma (2012) 2(1):1–10.
67. An G, Nieman G, Vodovotz Y. Hacia la identificación computacional de puntos de inflexión multiescala en la insuficiencia multiorgánica. Ann BioMed Eng (2012) 40:2412–24. doi: 10.1007/s10439-012-0565-9
68. Kitano H. Biología de sistemas: una breve reseña. Science (2002) 295(5560):1662–4. doi: 10.1126/science.1069492
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Csete ME, Doyle JC. Ingeniería inversa de la complejidad biológica. Science (2002) 295(5560):1664–9. doi: 10.1126/science.1069981
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Shansky RM, Lipps J. Disfunción cognitiva inducida por estrés: interacciones hormona-neurotransmisor en la corteza prefrontal. Front Hum Neurosci (2013) 7:123. doi: 10.3389/fnhum.2013.00123
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Glaser R, Kiecolt-Glaser JK. Disfunción inmunitaria inducida por estrés: implicaciones para la salud. Nat Rev Immunol (2005) 5(3):243–51. doi: 10.1038/nri1571
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Mechawar N, Savitz J. Neuropatología de los trastornos del estado de ánimo: ¿Vemos los estigmas de la inflamación? Transl Psychiatry (2016) 6(11):e946. doi: 10.1038/tp.2016.212
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Bush NR, Aschbacher K. Biomarcadores inmunitarios de la adversidad en la primera infancia y la exposición al estrés y la violencia: Buscando fuera del alumbrado público. JAMA Pediatr (2020) 174(1):17–9. doi: 10.1001/jamapediatrics.2019.3882
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Lee DS, Jiang T, Crocker J, Way BM. Uso de redes sociales y su relación con indicadores de salud física. Cyberpsychol Behav Soc Netw (2022) 25(2):87–93. doi: 10.1089/cyber.2021.0188
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Kraft P, Kraft B. Explicando las disparidades socioeconómicas en los comportamientos de salud: una revisión de las vías biopsicológicas relacionadas con el estrés y la inflamación. Neurosci Biobehav Rev (2021) 127:689–708. doi: 10.1016/j.neubioRev2021.05.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Day J, Rubin J, Vodovotz Y, Chow CC, Reynolds A, Clermont G. Un modelo matemático reducido de la respuesta inflamatoria aguda II. Captura de escenarios de administración repetida de endotoxinas. J Theor Biol (2006) 242(1):237–56. doi: 10.1016/j.jtbi.2006.02.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Rivière B, Epshteyn Y, Swigon D, Vodovotz Y. Un modelo matemático simple de la señalización resultante de la unión del lipopolisacárido con el receptor tipo Toll 4 demuestra un comportamiento inherente de preacondicionamiento. Math Biosci (2009) 217(1):19–26. doi: 10.1016/j.mbs.2008.10.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Kumar R, Clermont G, Vodovotz Y, Chow CC. Dinámica de la inflamación aguda. J Theor Biol (2004) 230(2):145–55. doi: 10.1016/j.jtbi.2004.04.044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Day JD, Park S, Ranard BL, Singh H, Chow CC, Vodovotz Y. Trayectorias divergentes de la enfermedad por COVID-19 predichas por un modelo de red inmunitaria centrado en DAMP. Front Immunol (2021) 12:754127. doi: 10.3389/fimmu.2021.754127
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Pinker S. Los mejores ángeles de nuestra naturaleza: por qué ha disminuido la violencia . Nueva York: Penguin Books (2012).
81. Friedman TL. El mundo es plano 3.0. Una breve historia del siglo XXI (actualizada y ampliada) . Nueva York: Farrar, Straus y Giroux (2007).
82. Shah AM, Ruben Z, Barclay D, Yin J, El-Dehaibi F, Addorisio M, et al. Inferencia computacional de las funciones mediadas por quimiocinas del nervio vago en la modulación de la inflamación intra e intertisular. Front Syst Biol (2024) 4:1266279. doi: 10.3389/fsysb.2024.1266279
83. Popovici K, Jerraya A. Capa de abstracción de hardware. En: Ecker W, Müller W, Dömer R, editores. Software dependiente del hardware . Dordrecht: Springer Países Bajos (2009). pp. 67–94. doi: 10.1007/978-1-4020-9436-1_4
84. Kirschner MW, Gerhart JC, Norton J. La plausibilidad de la vida resolviendo el dilema de Darwin . New Haven, CT: Yale University Press (2005).
85. Doyle JC, Csete M. Arquitectura, restricciones y comportamiento. Proc Natl Acad Sci USA (2011) 108(Supl. 3):15624–30. doi: 10.1073/pnas.1103557108
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Jacono FJ, Mayer CA, Hsieh YH, Wilson CG, Dick TE. Los niveles de citocinas pulmonares y del tronco encefálico se asocian con cambios en el patrón respiratorio en un modelo de lesión pulmonar aguda en roedores. Respir Physiol NeuroBiol (2011) 178(3):429–38. doi: 10.1016/j.resp.2011.04.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Hsieh YH, Litvin DG, Zaylor AR, Nethery DE, Dick TE, Jacono FJ. La inflamación del tronco encefálico modula el patrón ventilatorio y su variabilidad tras una lesión pulmonar aguda en roedores. J Physiol (2020) 598(13):2791–811. doi: 10.1113/JP279177
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Litvin DG, Denstaedt SJ, Borkowski LF, Nichols NL, Dick TE, Smith CB, et al. Comunicación inmunitaria periférica-central en la barrera glial del área postrema tras una lesión pulmonar estéril inducida por bleomicina en ratas adultas. Brain Behav Immun (2020) 87:610–33. doi: 10.1016/j.bbi.2020.02.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Belleau EL, Treadway MT, Pizzagalli DA. El impacto del estrés y el trastorno depresivo mayor en la morfología del hipocampo y la corteza prefrontal medial. Biol Psychiatry (2019) 85(6):443–53. doi: 10.1016/j.biopsych.2018.09.031
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. Bandelow B, Baldwin D, Abelli M, Bolea-Alamanac B, Bourin M, Chamberlain SR, et al. Marcadores biológicos para trastornos de ansiedad, TOC y TEPT: una declaración de consenso. Parte II: Neuroquímica, neurofisiología y neurocognición. World J Biol Psychiatry (2017) 18(3):162–214. doi: 10.1080/15622975.2016.1190867
Resumen de PubMed | Texto completo de CrossRef | Google Académico
91. Faye C, McGowan JC, Denny CA, David DJ. Mecanismos neurobiológicos de la resiliencia al estrés e implicaciones para la población de edad avanzada. Curr Neuropharmacol (2018) 16(3):234–70. doi: 10.2174/1570159X15666170818095105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
92. Theoharides TC, Stewart JM, Hatziagelaki E, Kolaitis G. «Niebla mental», inflamación y obesidad: aspectos clave de los trastornos neuropsiquiátricos mejorados con luteolina. Front Neurosci (2015) 9:225. doi: 10.3389/fnins.2015.00225
Resumen de PubMed | Texto completo de CrossRef | Google Académico
93. Yelland GW. Deterioro cognitivo inducido por gluten (“niebla mental”) en la enfermedad celíaca. J Gastroenterol Hepatol (2017) 32(Supl. 1):90–3. doi: 10.1111/jgh.13706
Resumen de PubMed | Texto completo de CrossRef | Google Académico
94. Luethi M, Meier B, Sandi C. Efectos del estrés en la memoria de trabajo, la memoria explícita y la memoria implícita ante estímulos neutros y emocionales en hombres sanos. Front Behav Neurosci (2008) 2:5.2008. doi: 10.3389/neuro.08.005.2008
95. Lukasik KM, Waris O, Soveri A, Lehtonen M, Laine M. Relación entre la ansiedad y el estrés y el rendimiento de la memoria de trabajo en una muestra amplia de sujetos sin depresión. Front Psychol (2019) 10:4. doi: 10.3389/fpsyg.2019.00004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
96. Yazdi AS, Ghoreschi K. La familia de la interleucina-1. Adv Exp Med Biol (2016) 941:21–9. doi: 10.1007/978–94–024–0921–5_2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
97. Heneka MT, Kummer MP, Stutz A, Delekate A, Schwartz S, Vieira-Saecker A, et al. NLRP3 se activa en la enfermedad de Alzheimer y contribuye a la patología en ratones APP/PS1. Nature (2013) 493(7434):674–8. doi: 10.1038/nature11729
Resumen de PubMed | Texto completo de CrossRef | Google Académico
98. Atrooz F, Salim S. Privación del sueño, estrés oxidativo e inflamación. Adv Protein Chem Struct Biol (2020) 119:309–36. doi: 10.1016/bs.apcsb.2019.03.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
99. Rosato E, Kyriacou CP. Orígenes de la ritmicidad circadiana. J Biol Rhythms (2002) 17(6):506–11. doi: 10.1177/0748730402238232
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Rao R, Androulakis IP. La importancia fisiológica de la dinámica circadiana del eje HPA: interacción entre los ritmos circadianos, la alostasis y la resiliencia al estrés. Horm Behav (2019) 110:77–89. doi: 10.1016/j.yhbeh.2019.02.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
101. Pevet P, Challet E, Felder-Schmittbuhl MP. Melatonina y el sistema circadiano: claves para la salud, con especial atención al sueño. Handb Clin Neurol (2021) 179:331–43. doi: 10.1016/B978-0-12-819975-6.00021-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
102. Maitra S, Bhattacharya D, Das S, Bhattacharya S. Melatonina y sus funciones antiglioma: una revisión exhaustiva. Rev Neurosci (2019) 30(5):527–41. doi: 10.1515/revneuro-2018–0041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
103. Tordjman S, Chokron S, Delorme R, Charrier A, Bellissant E, Jaafari N, et al. Melatonina: farmacología, funciones y beneficios terapéuticos. Curr Neuropharmacol (2017) 15(3):434–43. doi: 10.2174/1570159X14666161228122115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
104. Kim TW, Jeong JH, Hong SC. El impacto del sueño y las alteraciones circadianas en las hormonas y el metabolismo. Int J Endocrinol (2015) 2015:591729. doi: 10.1155/2015/591729
Resumen de PubMed | Texto completo de CrossRef | Google Académico
105. Ditmer M, Gabryelska A, Turkiewicz S, Białasiewicz P, Małecka-Wojciesko E, Sochal M. Problemas del sueño en enfermedades inflamatorias crónicas: prevalencia, tratamiento y nuevas perspectivas: una revisión narrativa. J Clin Med (2021) 11 (1). doi: 10.3390/jcm11010067
Resumen de PubMed | Texto completo de CrossRef | Google Académico
106. Bae SA, Fang MZ, Rustgi V, Zarbl H, Androulakis IP. En la interfaz entre estilo de vida, comportamiento y ritmos circadianos: implicaciones metabólicas. Front Nutr (2019) 6:132. doi: 10.3389/fnut.2019.00132
Resumen de PubMed | Texto completo de CrossRef | Google Académico
107. Wang Z, Chen WH, Li SX, He ZM, Zhu WL, Ji YB, et al. La microbiota intestinal modula la respuesta inflamatoria y el deterioro cognitivo inducidos por la privación del sueño. Mol Psychiatry (2021) 26(11):6277–92. doi: 10.1038/s41380-021-01113-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
108. Gregor MF, Hotamisligil GS. Mecanismos inflamatorios en la obesidad. Annu Rev Immunol (2011) 29:415–45. doi: 10.1146/annurev-immunol-031210-101322
Resumen de PubMed | Texto completo de CrossRef | Google Académico
109. Luci C, Bourinet M, Leclère PS, Anty R, Gual P. Inflamación crónica en la esteatohepatitis no alcohólica: mecanismos moleculares y estrategias terapéuticas. Frente Endocrinol (Lausana) (2020) 11:597648. doi: 10.3389/fendo.2020.597648
Resumen de PubMed | Texto completo de CrossRef | Google Académico
110. Lakhani HV, Sharma D, Dodrill MW, Nawab A, Sharma N, Cottrill CL, et al. Alteración fenotípica de los hepatocitos en la enfermedad del hígado graso no alcohólico. Int J Med Sci (2018) 15(14):1591–9. doi: 10.7150/ijms.27953
Resumen de PubMed | Texto completo de CrossRef | Google Académico
111. Wang XL, Li L. El reloj circadiano regula la inflamación y el desarrollo de la neurodegeneración. Front Cell Infect MicroBiol (2021) 11:696554. doi: 10.3389/fcimb.2021.696554
Resumen de PubMed | Texto completo de CrossRef | Google Académico
112. Dempsey JA, Veasey SC, Morgan BJ, O’Donnell CP. Fisiopatología de la apnea del sueño. Physiol. Rev (2010) 90(1):47–112. doi: 10.1152/physRev00043.2008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
113. Garbarino S, Lanteri P, Bragazzi NL, Magnavita N, Scoditti E. Rol de la privación de sueño en el riesgo y los resultados de enfermedades inmunológicas. Commun Biol (2021) 4(1):1304. doi: 10.1038/s42003-021-02825-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
114. Delaroque C, Chervy M, Gewirtz AT, Chassaing B. El hacinamiento social afecta la microbiota intestinal, promoviendo el estrés, la inflamación y la disglucemia. Gut Microbes (2021) 13(1):2000275. doi: 10.1080/19490976.2021.2000275
Resumen de PubMed | Texto completo de CrossRef | Google Académico
115. Yin Z, Lam TJ, Sin YM. Efectos del estrés por hacinamiento en la respuesta inmunitaria no específica de la carpa de lujo (Cyprinus carpio L.). Fish Shellfish Immunol (1995) 5(7):519–29. doi: 10.1016/S1050-4648(95)80052-2
116. Lin W, Li L, Chen J, Li D, Hou J, Guo H, et al. El estrés por hacinamiento a largo plazo provoca un deterioro de la inmunidad inespecífica y aumenta la apoptosis del bazo en la carpa herbívora (Ctenopharyngodon idella). Fish Shellfish Immunol (2018) 80:540–5. doi: 10.1016/j.fsi.2018.06.050
Resumen de PubMed | Texto completo de CrossRef | Google Académico
117. Finegood ED, Chen E, Kish J, Vause K, Leigh AKK, Hoffer L, et al. Violencia comunitaria e indicadores celulares y de citocinas de inflamación en adolescentes. Psychoneuroendocrinology (2020) 115:104628. doi: 10.1016/j.psyneuen.2020.104628
Resumen de PubMed | Texto completo de CrossRef | Google Académico
118. Lee MJ, Rittschof CC, Greenlee AJ, Turi KN, Rodriguez-Zas SL, Robinson GE, et al. Análisis transcriptómicos de mujeres negras en barrios con altos niveles de violencia. Psiconeuroendocrinología (2021) 127:105174. doi: 10.1016/j.psyneuen.2021.105174
Resumen de PubMed | Texto completo de CrossRef | Google Académico
119. Miller GE, Chen E, Finegood E, Shimbo D, Cole SW. Asociaciones prospectivas entre la violencia vecinal y la actividad transcripcional proinflamatoria de monocitos en niños. Brain Behav Immun (2022) 100:1–7. doi: 10.1016/j.bbi.2021.11.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
120. Booth A, Cowell J. Hacinamiento y salud. J Health Soc Behav (1976) 17(3):204–20. doi: 10.2307/2136543
Resumen de PubMed | Texto completo de CrossRef | Google Académico
121. Bellingrath S, Weigl T, Kudielka BM. El estrés laboral crónico y el agotamiento se asocian con una mayor carga alostástica en maestras. Stress (2009) 12(1):37–48. doi: 10.1080/10253890802042041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
122. Lee W, Kang SK, Choi WJ. Efecto de las largas jornadas laborales y el trabajo a turnos en los niveles de proteína C reactiva de alta sensibilidad en trabajadores coreanos. Scand J Work Environ Health (2021) 47(3):200–7. doi: 10.5271/sjweh.3933
Resumen de PubMed | Texto completo de CrossRef | Google Académico
123. Emeny RT, Zierer A, Lacruz ME, Baumert J, Herder C, Gornitzka G, et al. Carga inflamatoria asociada al estrés laboral y riesgo a largo plazo de eventos coronarios: hallazgos del estudio de cohorte de casos Monica/KORA Augsburg. Psychosom Med (2013) 75(3):317–25. doi: 10.1097/PSY.0b013e3182860d63
Resumen de PubMed | Texto completo de CrossRef | Google Académico
124. Kaltenegger HC, Becker L, Rohleder N, Nowak D, Weigl M. Asociaciones entre las condiciones laborales y la inflamación crónica leve en empleados: una revisión sistemática y un metaanálisis. Scand J Work Environ Health (2021) 47(8):565–81. doi: 10.5271/sjweh.3982
Resumen de PubMed | Texto completo de CrossRef | Google Académico
125. Liu J, Huang S, Zhang X, Li G, Batsuren E, Lu W, et al. La microbiota intestinal refleja el estrés por hacinamiento debido a la falta de espacio y al contacto físico y no físico en los topillos de Brandt (Lasiopodomys brandtii). MicroBiol Res (2021) 255:126928. doi: 10.1016/j.micres.2021.126928
Resumen de PubMed | Texto completo de CrossRef | Google Académico
126. Roser M, Ritchie H, Ortiz-Ospina E, Rodés-Guirao L. Crecimiento de la población mundial. Nuestro Mundo en Datos. (2013). Disponible en: https://ourworldindata.org/ .
127. Velasquez-Manoff M. Una epidemia de ausencia: una nueva forma de comprender las alergias y las enfermedades autoinmunes . Nueva York: Scribner (2013).
128. DeVylder J, Fedina L, Link B. Impacto de la violencia policial en la salud mental: un marco teórico. Am J Public Health (2020) 110(11):1704–10. doi: 10.2105/AJPH.2020.305874
Resumen de PubMed | Texto completo de CrossRef | Google Académico
129. Metsios GS, Moe RH, Kitas GD. Ejercicio e inflamación. Best Pract. Res. Clin Rheumatol (2020) 34(2):101504. doi: 10.1016/j.berh.2020.101504
Resumen de PubMed | Texto completo de CrossRef | Google Académico
130. Gebel K, Ding D, Chey T, Stamatakis E, Brown WJ, Bauman AE. Efecto de la actividad física moderada a vigorosa en la mortalidad por todas las causas en australianos de mediana edad y mayores. JAMA Intern Med (2015) 175(6):970–7. doi: 10.1001/jamainternmed.2015.0541
Resumen de PubMed | Texto completo de CrossRef | Google Académico
131. Bighelli I, Castellazzi M, Cipriani A, Girlanda F, Guaiana G, Koesters M, et al. Antidepresivos versus placebo para el trastorno de pánico en adultos. Cochrane Database Syst Rev (2018) 4(4):CD010676. doi: 10.1002/14651858.CD010676.pub2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
132. Taylor MJ, Freemantle N, Geddes JR, Bhagwagar Z. Inicio temprano de la acción antidepresiva de los inhibidores selectivos de la recaptación de serotonina: revisión sistemática y metaanálisis. Arch Gen Psychiatry (2006) 63(11):1217–23. doi: 10.1001/archpsyc.63.11.1217
Resumen de PubMed | Texto completo de CrossRef | Google Académico
133. Gomollón-Bel F, García-Martínez J. Soluciones químicas a la policrisis actual. Angew Chem Int Ed Engl (2023) 62(25):e202218975. doi: 10.1002/anie.202218975
Resumen de PubMed | Texto completo de CrossRef | Google Académico
134. Rao R, Androulakis IP. Adaptación alostática y compensaciones fisiológicas personalizadas en la regulación circadiana del eje HPA: un enfoque de modelado matemático. Sci Rep (2019) 9(1):11212. doi: 10.1038/s41598-019-47605-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
135. Lam PH, Chen E, Chiang JJ, Miller GE. Desventaja socioeconómica, estrés crónico y fenotipo proinflamatorio: un análisis integrativo de datos a lo largo de la vida. PNAS Nexus (2022) 1(4):pgac219. doi: 10.1093/pnasnexus/pgac219
Resumen de PubMed | Texto completo de CrossRef | Google Académico
136. Petersen BK, Yang J, Grathwohl WS, Cockrell C, Santiago C, An G, et al. Aprendizaje de refuerzo profundo y simulación como camino hacia la medicina de precisión. J Comput Biol (2019) 26:597–604. doi: 10.1089/cmb.2018.0168
Resumen de PubMed | Texto completo de CrossRef | Google Académico
137. Cockrell RC, An G. Examen de la controlabilidad de la sepsis mediante algoritmos genéticos en un modelo de inflamación sistémica basado en agentes. PloS Comput Biol (2018) 14(2):e1005876. doi: 10.1371/journal.pcbi.1005876
Resumen de PubMed | Texto completo de CrossRef | Google Académico
138. Day JD, Cockrell C, Namas R, Zamora R, An G, Vodovotz Y. Inflamación y enfermedad: modelado y modulación de la respuesta inflamatoria para aliviar enfermedades críticas. Curr Opin Syst Biol (2018) 12:22–9. doi: 10.1016/j.coisb.2018.08.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
139. Namas RA, Mikheev M, Yin J, Barclay D, Jefferson B, Mi Q, et al. Un circuito adaptativo de retroalimentación negativa en un dispositivo biohíbrido reprograma redes dinámicas de inflamación sistémica in vivo . Front Syst Biol (2023) 2:926618. doi: 10.3389/fsysb.2022.926618
140. Fairbank EJ, McGrath JJ, Henderson M, O’Loughlin J, Paradis G. Apoyo social y proteína C reactiva en una cohorte poblacional de niños y adolescentes de Quebec. PloS One (2022) 17(6):e0268210. doi: 10.1371/journal.pone.0268210
Resumen de PubMed | Texto completo de CrossRef | Google Académico
141. Den H, Dong X, Chen M, Zou Z. Eficacia de los probióticos en la cognición y biomarcadores de inflamación y estrés oxidativo en adultos con enfermedad de Alzheimer o deterioro cognitivo leve: un metaanálisis de ensayos controlados aleatorizados. Aging (Albany, NY) (2020) 12(4):4010–39. doi: 10.18632/aging.102810
Resumen de PubMed | Texto completo de CrossRef | Google Académico
143. Verschure PFMJ, Wierenga S. Memoria futura: un enfoque de humanidades digitales para la preservación y presentación de la historia del Holocausto y los crímenes nazis. Holocaust Stud (2022) 28(3):331–57. doi: 10.1080/17504902.2021.1979178
144. Kiecolt-Glaser JK, Derry HM, Fagundes CP. Inflamación: la depresión aviva las llamas y se alimenta del calor. Am J Psychiatry (2015) 172(11):1075–91. doi: 10.1176/appi.ajp.2015.15020152
Resumen de PubMed | Texto completo de CrossRef | Google Académico
145. Miossec P, Kolls JK. Dirigido a las células IL-17 y TH17 en la inflamación crónica. Nat Rev Drug Discovery (2012) 11(10):763–76. doi: 10.1038/nrd3794
146. Ghoreschi K, Balato A, Enerbäck C, Sabat R. Terapéuticas dirigidas a la vía IL-23 e IL-17 en la psoriasis. Lanceta (2021) 397(10275):754–66. doi: 10.1016/S0140-6736(21)00184-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
147. Pavlov VA, Chavan SS, Tracey KJ. Neurociencia molecular y funcional en inmunidad. Annu Rev Immunol (2018) 36:783–812. doi: 10.1146/annurev-immunol-042617-053158
Resumen de PubMed | Texto completo de CrossRef | Google Académico
148. Yehuda R, Lehrner A. Transmisión intergeneracional de los efectos del trauma: posible papel de los mecanismos epigenéticos. World Psychiatry (2018) 17(3):243–57. doi: 10.1002/wps.20568
Resumen de PubMed | Texto completo de CrossRef | Google Académico
149. Abul-Husn NS, Kenny EE. Medicina personalizada y el poder de los historiales médicos electrónicos. Cell (2019) 177(1):58–69. doi: 10.1016/j.cell.2019.02.039
Resumen de PubMed | Texto completo de CrossRef | Google Académico
150. Ho D, Quake SR, McCabe ERB, Chng WJ, Chow EK, Ding X, et al. Tecnologías facilitadoras para la medicina personalizada y de precisión. Trends Biotechnol (2020) 38(5):497–518. doi: 10.1016/j.tibtech.2019.12.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
151. Verschure PF, Pascoa F, Sharma V. Redefiniendo la rehabilitación del ictus: Movilizando el cerebro corporal orientado a objetivos. Curr Opin Neurol (2023) 83:102807. doi: 10.1016/j.conb.2023.102807
152. Vodovotz Y. Modelado computacional de la respuesta inflamatoria en trauma, sepsis y cicatrización de heridas: implicaciones para el modelado de la resiliencia. Interface Focus (2014) 4(5):20140004. doi: 10.1098/rsfs.2014.0004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
153. Tong S, Bambrick H, Beggs PJ, Chen L, Hu Y, Ma W, et al. Amenazas actuales y futuras para la salud humana en el Antropoceno. Environ Int (2022) 158:106892. doi: 10.1016/j.envint.2021.106892
Resumen de PubMed | Texto completo de CrossRef | Google Académico
154. Galland L. Dieta e inflamación. Nutr Clin Pract (2010) 25(6):634–40. doi: 10.1177/0884533610385703
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Apéndice
El modelo matemático utilizado para simular el impacto de diferentes condiciones de estrés en la respuesta inflamatoria y la cognición comprende cinco ecuaciones diferenciales ordinarias que rastrean los cambios en el estrés ( S ), la inflamación ( M ), el controlador ( C ), la curación ( H ) y la intervención ( I ). La descripción de las ecuaciones del modelo se basa en la perspectiva individual, pero podría traducirse a una interpretación social, como se sugirió anteriormente. Todas las variables y parámetros del modelo se expresan en unidades arbitrarias debido a la falta de datos para la calibración.
En la Ecuación 1, se modela la tasa de cambio del estrés para rastrear los niveles de estrés en un individuo. El primer término representa cómo el estrés puede desviarse de un nivel de referencia o línea base de estrés ( S ref ) que se supone está presente en cualquier individuo. Seis factores de ejemplo ( f i , donde i = 1, 2, …, 6) que generan estrés se incluyen en el modelo. Como se describe en el texto, estos podrían interpretarse como factores internos (p. ej., dieta, inactividad física, deficiencia de sueño) o factores externos (infección, factores climáticos o ambientales, estrés digital); cualquier factor adicional podría cuantificarse fácilmente (y eventualmente). Se supone que estos factores de estrés varían entre 0 ≤ f i ≤ 1, donde f i = 1 indica el nivel más alto de estrés que puede ser invocado por ese factor, p. ej., la dieta más proinflamatoria ( 154 ), y f i = 0 indica una reducción en el nivel de estrés que podría ser causado por ese factor, p. ej., elegir una dieta vegana que sea mínimamente proinflamatoria. Un valor f i = 0,5 indica una contribución basal que conduciría a la homeostasis basada en ese factor. El producto de S ref y una función lineal de estos seis factores ( f i ) proporciona el grado en que el estrés aumenta o disminuye con respecto a S ref , según la combinación de factores para cualquier individuo dado. Estas entradas de estrés se inhiben mediante la intervención externa (I), dada por la presencia de (1 + I ) en el denominador. El segundo término de la Ecuación 1 representa el aumento del estrés debido a la respuesta inflamatoria (un término 3 ), que se inhibe mediante la curación ( término H / H ∞ ).
dSdel=−micrasS[S−SomiF(alfa(F1+F2+F3+F4+F5+F6 1+I)+β)]+a3(METRO1+(HH∞)2)2a42+(METRO1+(HH∞)2)2(1)
En la Ecuación 2, la respuesta proinflamatoria se desencadena en presencia de estrés ( v 1 S ), pero se inhibe por el control neuronal ( k c C ), la curación ( k H H ) y la intervención externa ( k I I ). También se asume una disminución natural en el segundo término.
dMETROdel=(v1S (v2+S)(do3+kdodo+kHH+kII))−micrasMETROMETRO(2)
La ecuación 3 muestra la tasa de cambio en la variable de control. El primer término incluye el concepto de resiliencia dentro de un individuo. Este modelo fue diseñado para incluir la posibilidad de que la exposición al estrés no conduzca únicamente a distrés ; el estrés puede ser útil (es decir, eustrés ) para un sistema biológico (ya sea individual o poblacional). En el modelo, si el estrés permanece por debajo de un nivel umbral ( S crit ), entonces el estrés ayuda a mejorar el controlador (que es como definimos el eustrés funcionalmente). Sin embargo, el estrés que aumenta por encima de S crit actúa perjudicialmente en el controlador (la definición funcional de distrés). Este parámetro, S crit , es específico del individuo y, por lo tanto, puede variarse para tener en cuenta los diferentes niveles de resiliencia en cada individuo. En el segundo término, la curación ( η 1 H ) y la intervención γ 3 I ) ayudan a promover las capacidades de control neuronal del sistema, mientras que la inflamación las disminuye ( c 2 + k M M ). También se incluye un término de decaimiento natural ( μ C C ) que sirve para regular la función del controlador.
ddodel=kS(Sdooiel−S)+(η1H+gamma3I do2+kMETROMETRO)−micrasdodo(3)
Como se muestra en la ecuación 4, se supone que la curación aumenta con la inflamación ( a 1 M ), el control neuronal ( a 2 C ) y la intervención externa ( γ 4 I ), con un efecto de saturación asumido y disminuye con la descomposición natural μ H .
dHdel=(a1METRO+a2do+gamma4Ido1+a1METRO+a2do+gamma4I)−micrasHH(4)
Finalmente, el modelo rastrea una intervención externa y se asume que inicialmente es cero. El modelo incluye varias funciones dependientes del tiempo para la intervención que se utilizan para simular una única intervención a largo plazo (p. ej., tratamiento con medicación, Ec. 5a) o múltiples intervenciones a corto plazo (p. ej., ejercicio unas cuantas veces por semana, Ec. 5b), donde t i indica el momento en que se administra el tratamiento. Las iteraciones futuras del modelo podrían permitir que la intervención dependa del estrés, ya que podría asumirse que un sistema sometido a mayor estrés será tratado con niveles más altos de intervención. Todas las variables y parámetros del modelo se expresan en unidades arbitrarias, y la descripción y los valores de los parámetros se dan en la Tabla 1. Los archivos con los códigos abiertos del modelo están disponibles en la Hoja de Datos Suplementaria .
dIdel=1τ(Imetroaincógnita1+miel−eli−I)(5a)
dIdel=∑i=1nortenorteImetroaincógnita1τ(1(1+mi(2i−1)eli−el)(1+miel−2ieli)−I)(5b)
Palabras clave: estrés, sociedad, cambio climático, redes sociales, inflamación, modelo matemático
Cita: Vodovotz Y, Arciero J, Verschure PFMJ y Katz DL. Un mapa inflamatorio multiescala: vinculando el estrés individual con la disfunción social. Front Sci (2024) 1:1239462. doi: 10.3389/fsci.2023.1239462
Recibido: 13 de junio de 2023; Aceptado: 17 de noviembre de 2023;
Publicado: 12 de marzo de 2024.
Editado por:
Denise Kirschner , Universidad de Michigan, Estados Unidos
Revisado por:
Pietro Ghezzi , Universidad de Urbino Carlo Bo, Italia
Ioannis P. Androulakis , Rutgers, Universidad Estatal de Nueva Jersey, Estados Unidos
Copyright © 2024 Vodovotz, Arciero, Verschure y Katz. Este artículo es de acceso abierto y se distribuye bajo los términos de la Licencia Creative Commons Atribución (CC BY) . Se permite su uso, distribución y reproducción en otros foros, siempre que se cite al autor original y al titular de los derechos de autor, y se cite la publicación original en esta revista, de acuerdo con la práctica académica aceptada. No se permite ningún uso, distribución ni reproducción que no cumpla con estos términos.
*Correspondencia: Yoram Vodovotz, vodovotzy@upmc.edu
† Todos los autores han contribuido por igual a este trabajo.
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son exclusivamente de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las de la editorial, los editores ni los revisores. El editor no garantiza ni avala ningún producto evaluado en este artículo ni ninguna afirmación realizada por su fabricante.





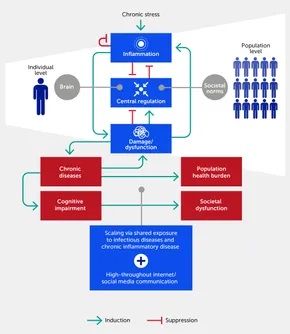

 Yoram Vodovotz
Yoram Vodovotz Julia Arciero
Julia Arciero Paul F. M. J. Verschure
Paul F. M. J. Verschure David L. Katz
David L. Katz