- 1 Departamento de Oftalmología, Centro Médico de la Universidad de Duke, Durham, Carolina del Norte, Estados Unidos
- 2 Foster Eye Center for Ocular Immunology, Duke Eye Center, Durham, Carolina del Norte, Estados Unidos
- 3 Tecnológico de Monterrey, Facultad de Medicina y Ciencias de la Salud, Instituto de Oftalmología y Ciencias Visuales, Monterrey, México
Los agentes antidisturbios (ARC) son compuestos químicos utilizados por las fuerzas del orden para sofocar manifestaciones violentas como alternativa a la fuerza letal y como parte del entrenamiento policial y militar. También se los conoce como gases lacrimógenos debido a la característica irritación ocular y lagrimeo que causan. Los ARC más comunes incluyen oleorresina capsicum (contenida en Mace y gas pimienta), clorobencilideno malononitrilo, dibenzoxazepina y cloroacetofenona (anteriormente el principal componente de Mace); algunos de los cuales se han utilizado durante décadas. Sus efectos incapacitantes inmediatos están mediados por fibras aferentes polimodales que inervan la superficie corneal, induciendo la liberación de péptidos que causan inflamación neurogénica. Aunque anteriormente se pensaba que solo tenían efectos transitorios en pacientes expuestos, pueden ocurrir complicaciones más graves como opacidades del estroma corneal, neovascularización corneal, queratopatía neurotrófica, necrosis conjuntival y pseudopterigión. Es preocupante que la falta de investigaciones y terapias específicas limite el tratamiento actual a la descontaminación y al apoyo adaptado a los síntomas. Este manuscrito proporcionará una descripción general de los mecanismos tóxicos de las RCA, sus manifestaciones clínicas y la terapia actual después de la exposición a gases lacrimógenos.
1 Introducción
Los agentes de control de disturbios (RCA), también conocidos como agentes químicos de control de multitudes, son agentes químicos que causan discapacidad temporal, generalmente un poco más larga que el período de exposición ( Menezes et al., 2016 ). Representan una alternativa no letal y no confrontativa para que las autoridades pacificen grandes multitudes que causan un disturbio civil o reduzcan el avance de las fuerzas militares enemigas ( Toprak et al., 2015 ). Para controlar multitudes violentas, el RCA ideal tiene un inicio de acción rápido, una breve duración de los efectos y un buen perfil de seguridad para evitar daños permanentes ( Kim et al., 2016 ). Por el contrario, para obstaculizar el avance de una fuerza militar, el químico idealmente debería permanecer en el ambiente durante semanas o meses ( Menezes et al., 2016 ). Debido a su facilidad de uso e inicio de acción inmediato, los productos químicos aerosolizados, los llamados gases lacrimógenos, son los RCA más utilizados, incluyendo cloroacetofenona (CN), oleorresina capsicum (OC), dibenzoxazepina (CR) y clorobencilideno malononitrilo (CS) ( Brown et al., 2000 ; Zollman et al., 2000 ; Yeung y Tang, 2015 ). Estos productos químicos son los principales componentes de los aerosoles de pimienta, y CN fue el compuesto activo en la fórmula original del producto comercializado como «Mace» para uso de autodefensa o como disuasivo animal (maza de osos). Sin embargo, OC y CS solos o en combinación han reemplazado a CN en formulaciones modernas debido a perfiles de efectos menos tóxicos ( Smith y Greaves, 2002 ; Kearney et al., 2014 ). Hasta el día de hoy, la exposición a estos agentes es parte del régimen de entrenamiento utilizado en algunas academias de aplicación de la ley.
Los gases lacrimógenos incapacitan rápidamente a la víctima al infligir daño a la superficie ocular, la parte más externa del ojo ( Krishnatreyya et al., 2018b ). La extensión del daño varía según la forma de administración. En el contexto agudo, los agentes aerosolizados pueden causar lagrimeo, eritema, edema conjuntival, visión borrosa y dolor ocular ( Dimitroglou et al., 2015 ). Por el contrario, las armas explosivas pueden causar daño térmico, químico y físico impuesto por la explosión ( MacLeod, 1969 ; Tidwell y Wills, 2019 ). Si no se tratan, los gases lacrimógenos pueden provocar una pérdida permanente de la visión debido a la cicatrización conjuntival y la pérdida de la sensibilidad corneal que conduce a neovascularización, adelgazamiento del estroma, ulceración, infección y perforación ( Levine y Stahl, 1968 ). Aunque es poco frecuente, la ceguera también puede ser consecuencia de glaucoma secundario, formación de cataratas, hemorragia vítrea y neuropatía óptica traumática ( Kim et al., 2016 ). Por lo tanto, es necesario un tratamiento agudo y un seguimiento cuidadoso después de la exposición ocular a las RCA para evitar complicaciones que amenacen la visión.
Las ramificaciones que surgen del uso de estas sustancias no se limitan solo a los ojos. El sistema respiratorio es el otro objetivo principal de las RCA, pero se puede observar sintomatología dermatológica, gastrointestinal e incluso neurológica ( Hu et al., 1989 ; Dimitroglou et al., 2015 ). Dependiendo de la concentración utilizada y la duración de la exposición, las manifestaciones varían desde rinorrea copiosa, estornudos, salivación y eritema cutáneo hasta complicaciones más graves como edema laríngeo, edema pulmonar, quemaduras químicas y ataques de pánico ( Vaca et al., 1996 ; Varma y Holt, 2001 ). Algunas de estas exposiciones han demostrado ser letales ( Haar et al., 2017 ). Considerando que los ojos son uno de los principales objetivos de las RCA, es crucial que los médicos tengan conocimiento de cómo podrían presentarse estos pacientes. Esta revisión tiene como objetivo proporcionar una descripción general actualizada de la presentación clínica, los mecanismos patogénicos y el tratamiento de la toxicidad de la superficie ocular inducida por RCA.
2 Antecedentes históricos y datos epidemiológicos
El uso de gases venenosos se reportó ya en 430, 431 a. C. cuando los espartanos liberaron gases irritantes de carbón, cera ardiente y brea al medio ambiente durante la Guerra del Peloponeso contra los atenienses ( Sanford, 1976 ). Durante la Primera Guerra Mundial (1914-1918 d. C.), el ejército alemán fue el primero en utilizar agentes químicos que causaban discapacidad temporal al producir blefaroespasmo y lagrimeo excesivos, entre ellos la cloropicrina, el bromuro de bencilo y la acroleína, entre otros. A principios de la década de 1920, los civiles podían comprar dispositivos de gas lacrimógeno de bolsillo que contenían CN para llevarlos con fines de autodefensa ( Sanford, 1976 ; Frey et al., 2022 ). En 1925, en Ginebra, se firmó el Protocolo para la Prohibición del Empleo en la Guerra de Gases Asfixiantes, Tóxicos o Similares y de Métodos Bacteriológicos de Guerra bajo los auspicios de la ( Organización Mundial de la Salud, 1970 ). A pesar de esto último, Estados Unidos firmó una orden ejecutiva en 1975 que permitía utilizar las RCA en ciertas situaciones, incluido el control de prisioneros de guerra y la protección de convoyes fuera de la zona de combate; por lo que no consideran a las RCA como agentes de guerra ( Frey et al., 2022 ).
Durante 1998-2002, los centros de control de intoxicaciones de Texas informaron de 1.531 exposiciones humanas al gas pimienta (OC) ( Forrester y Stanley, 2003 ). De ellas, el 84% fueron involuntarias, el 68% se produjeron en el hogar, el 64% afectaron a niños y adolescentes y el 56% se produjeron en hombres ( Forrester y Stanley, 2003 ). En 2017, el Sistema Nacional de Datos sobre Intoxicaciones (NPDS) informó de un total de 4.007 exposiciones a gases lacrimógenos, incluidos OC (83%), CN (12%), CS (0,2%) y otros (4%) ( Gummin et al., 2018 ). Aunque el 25% de los casos se trataron en un centro de atención sanitaria, solo el 0,12% de las víctimas sufrieron consecuencias adversas importantes ( Gummin et al., 2018 ).
3 Sistemas de entrega de agentes antidisturbios (RCA)
Los RCA suelen denominarse «gases lacrimógenos». Sin embargo, en lugar de ser un gas, se componen como un aerosol de partículas sólidas ( Rothenberg et al., 2016 ). Pueden proyectarse a partir de soluciones o como dispersiones en el aire. Mientras que los primeros incluyen aerosoles de defensa personal y cartuchos de gas, botes y granadas empleados por las fuerzas del orden ( Ilgaz et al., 2019 ), los segundos contienen dispersiones generadas como humo, nieblas de aerosol o nubes de polvo ( Ballantyne, 2006 ). Los dispositivos portátiles contienen formulaciones líquidas liberadas a través de aerosoles presurizados de ángulo estrecho o amplio para incapacitar a una persona ( Schep et al., 2015 ). Por otro lado, los botes y las granadas son una mezcla pirotécnica mezclada con una forma de polvo que se aerosoliza para su dispersión como humo ( Olajos y Stopford, 2004 ; Rothenberg et al., 2016 ). Estos dispositivos pirotécnicos de gas lacrimógeno pueden alcanzar objetivos a una distancia de hasta 300 m2 , lo que resulta ideal para el control de multitudes en disturbios ( Rothenberg et al., 2016 ). También se utilizan tecnologías guiadas por aeronaves, vehículos y drones como sistemas de lanzamiento. Además, las armas de proyectiles no letales tienen un alto riesgo de inducir lesiones traumáticas graves cuando se disparan contra una persona ( Ifantides et al., 2020 ).
4 Características anatómicas
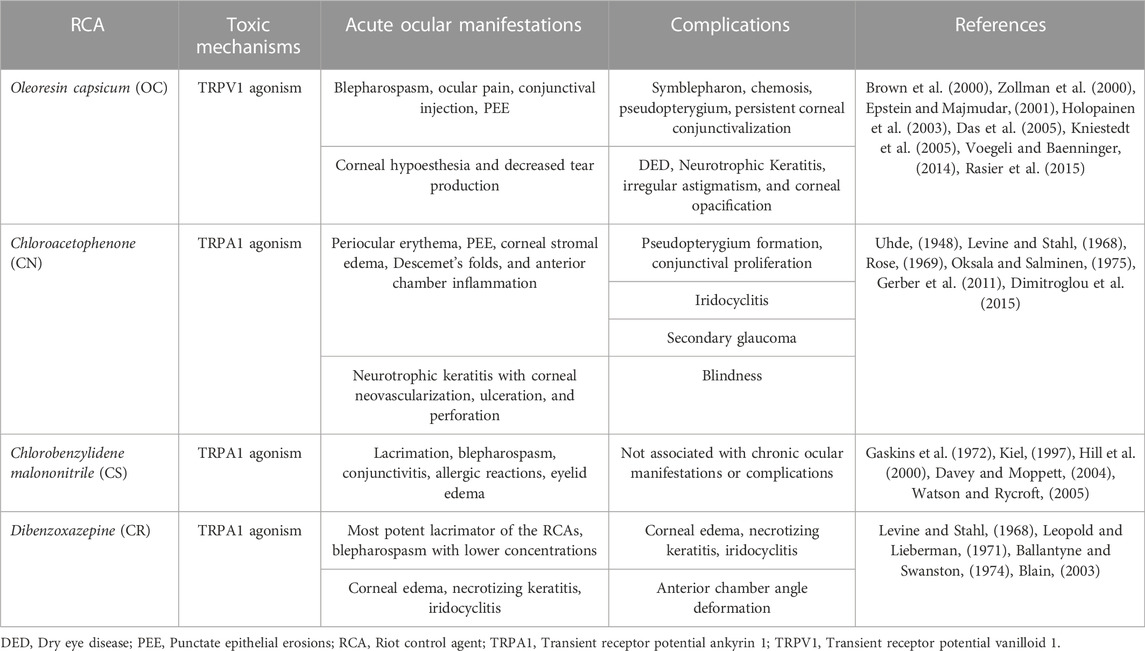
La córnea es el tejido más densamente inervado del cuerpo. La rama oftálmica (V 1 ) del nervio trigémino supervisa las funciones nociceptivas del ojo, incluido el reflejo de parpadeo, la producción de lágrimas y la cicatrización de heridas ( Ruiz-Lozano et al., 2021 ). El nervio nasociliar, una rama V 1 , ingresa a la órbita para cubrir la superficie ocular. Las ramas del nervio nasociliar se decusan, perforan la esclerótica y viajan anteriormente para inervar el limbo corneoescleral y el estroma corneal ( Marfurt et al., 2010 ). Posteriormente, forman el plexo subepitelial y cruzan la membrana de Bowman para formar el plexo nervioso subbasal, que inerva el epitelio corneal ( Marfurt et al., 2010 ; Ruiz-Lozano et al., 2021 ). Existen tres tipos de nervios corneales sensoriales, todos los cuales evocan dolor. Se clasifican en neuronas nociceptoras polimodales, mecanorreceptores puros y termorreceptores de frío según los estímulos nocivos activadores ( Belmonte et al., 2015 ; Belmonte et al., 2017 ). El mecanismo de acción de los gases lacrimógenos se produce debido a la activación de los canales iónicos de potencial receptor transitorio (TRP), un grupo de receptores quimiosensoriales sensibilizadores ubicados en las terminaciones nerviosas periféricas ( Rothenberg et al., 2016 ; Frey et al., 2022 ). El vanilloide TRP (TRPV1), un agonista de OC, también conocido como capsaicina, y la anquirina (TRPA1) agonista de CS, CN y CR, son dos subfamilias de canales iónicos TRP ( Schep et al., 2015 ). Ambos se expresan en los nervios nociceptivos periféricos sensibles al dolor de la piel, las membranas mucosas de los pulmones y las vías respiratorias superiores e inferiores, y la superficie ocular (córnea y conjuntiva) ( Rothenberg et al., 2016 ).
5 Toxicidad de la superficie ocular de productos químicos específicos utilizados como agentes antidisturbios (ACR)
5.1 Oleorresina de capsaicina (OC)
5.1.1 Propiedades químicas
El OC es una mezcla de fenoles liposolubles (capsaicinoides) obtenidos de las plantas de pimiento Capsicum frutescens y Capsicum annuum ( Ballantyne, 2006 ). La capsaicina (C 18 H 27 NO 3 ), el componente principal del OC, tiene un punto de fusión y ebullición de 64 °C y 210–220 °C, respectivamente, y un peso molecular de 305,41. El umbral de irritación ocular es de 0,002 mg/m 3 ( Schep et al., 2015 ; Kim et al., 2016 ). La concentración de OC en los aerosoles de pimienta varía entre los fabricantes (1,2%–12,6%) ( Ballantyne, 2006 ).
5.1.2 Mecanismo de toxicidad
La capsaicina tiene actividad agonista en TRPVI, un canal no selectivo permeable al calcio y al sodio en las neuronas sensoriales corneales ( Belmonte et al., 2017 ; Alamri et al., 2018 ). Ante estímulos dolorosos con OC, el canal TRPV1 se abre, permitiendo la entrada de calcio con la consiguiente inactivación del canal y la consiguiente analgesia ( Bates et al., 2010 ). Además del dolor, los estímulos de OC también desencadenan una respuesta inflamatoria, la denominada inflamación neurogénica. Este proceso también implica la despolarización de la membrana a través de la apertura no selectiva del canal, aumentando así el calcio y el sodio intracelulares, lo que permite la liberación de neuropéptidos por neuronas nociceptivas polimodales como la sustancia P y el péptido relacionado con el gen de la calcitonina ( Kumar et al., 2018 ). El modelo de inflamación neurogénica implica la hipótesis del reflejo axónico, donde la despolarización de la fibra aferente desencadena un potencial de acción que viaja en una dirección hacia el SNC para provocar la sensación de dolor (estimulación ortodrómica); además, en los puntos de ramificación axónica, un impulso nervioso en dirección opuesta induce la liberación de neuropéptidos de las terminaciones nerviosas aferentes cercanas para potenciar la inflamación (estimulación antidrómica) ( Yeung y Tang, 2015 ; Sorkin et al., 2018 ). Una representación esquemática de estos mecanismos se encuentra en la Figura 1 .
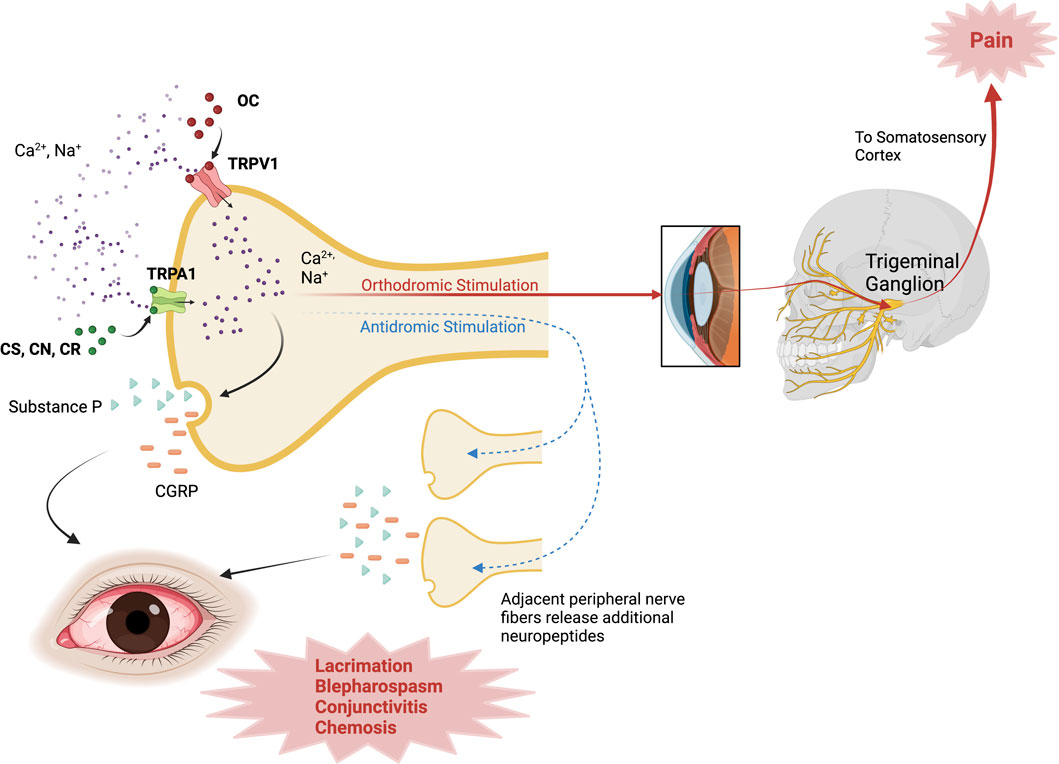 FIGURA 1. Mecanismo de acción de los agentes antidisturbios. El OC activa los canales TRPV1; mientras que el CS, CN y CR activan los canales TRPA1 en las neuronas sensoriales corneales, lo que induce la entrada de Ca2 + . Con la estimulación ortodrómica, el impulso viaja a través de la vía trigémina hasta la corteza somatosensorial y provoca la sensación de dolor. En la estimulación antidrómica, la activación del canal TRP desencadena un impulso que viaja a las fibras nerviosas adyacentes, lo que induce la liberación de neuropéptidos adicionales (es decir, SP, CGRP) para propagar la inflamación. CGRP, péptido relacionado con el gen de la calcitonina; CN, cloroacetofenona; CR, dibenzoxazepina; CS, clorobencilide malononitrilo; TRPA1, potencial transitorio del receptor anquirina 1; TRPV1, potencial transitorio del receptor vanilloide 1. Creado con Biorender.com .
FIGURA 1. Mecanismo de acción de los agentes antidisturbios. El OC activa los canales TRPV1; mientras que el CS, CN y CR activan los canales TRPA1 en las neuronas sensoriales corneales, lo que induce la entrada de Ca2 + . Con la estimulación ortodrómica, el impulso viaja a través de la vía trigémina hasta la corteza somatosensorial y provoca la sensación de dolor. En la estimulación antidrómica, la activación del canal TRP desencadena un impulso que viaja a las fibras nerviosas adyacentes, lo que induce la liberación de neuropéptidos adicionales (es decir, SP, CGRP) para propagar la inflamación. CGRP, péptido relacionado con el gen de la calcitonina; CN, cloroacetofenona; CR, dibenzoxazepina; CS, clorobencilide malononitrilo; TRPA1, potencial transitorio del receptor anquirina 1; TRPV1, potencial transitorio del receptor vanilloide 1. Creado con Biorender.com .
En un modelo de conejo, Gallar et al. demostraron una cicatrización tardía de las heridas corneales después de la aplicación tópica y retrobulbar de capsaicina, lo que sugiere daño a las terminaciones de las fibras del nervio trigémino y agotamiento de neuropéptidos ( Gallar et al., 1990 ). En un modelo murino, Lambiase et al. observaron una disminución significativa en la inervación corneal, la sensibilidad periférica, la tasa de cicatrización corneal y la secreción de lágrimas después de la inyección subcutánea de capsaicina ( Lambiase et al., 2012 ). Después del desbridamiento epitelial, los autores informan una disminución significativa en el factor de crecimiento nervioso (NGF), un factor crucial que supervisa la proliferación y supervivencia de las neuronas sensoriales ( Lambiase et al., 2012 ).
5.1.3 Manifestaciones oculares
La irritación ocular puede ocurrir con partículas pequeñas de capsaicina (2 µm), mientras que la irritación severa y prolongada ocurre con partículas más extensas (50 µm). Aunque las propiedades liposolubles de la capsaicina confieren la capacidad de penetrar fácilmente el epitelio corneal, su escasa solubilidad en agua evita dañar las capas corneales más profundas ( Krishnatreyya et al., 2018a ). En 47 cadetes, Zollman et al. informaron inyección conjuntival, dolor variable y blefaroespasmo en todos los casos, erosiones epiteliales puntiformes (PEE, 21%) y una reducción significativa de la sensibilidad corneal, medida con el estesiómetro Cochet-Bonnet 10 min después de la exposición al spray pimienta (5,7 ± 0,4 cm frente a 0,6 ± 1,0 cm) durante un ejercicio de entrenamiento ( Zollman et al., 2000 ). Después de una semana, la PEE se curó y se restableció la sensibilidad corneal ( Zollman et al., 2000 ). Vesaluoma et al. también encontraron una disminución de la sensibilidad corneal y cambios transitorios en la microscopía confocal in vivo (IVCM), incluida la hinchazón del epitelio corneal, en diez oficiales de policía expuestos a OC en un entorno controlado ( Vesaluoma et al., 2000 ).
Aunque los resultados de los estudios previos sugieren que el OC es inocuo para la superficie ocular, en todos ellos, la exposición ocurrió en un entorno controlado. Se produjeron abrasiones corneales sostenidas en el 7% de los sujetos en el departamento de emergencias de una cárcel expuestos a spray de pimienta a una concentración del 10% ( Brown et al., 2000 ). Holopainen et al. informaron de daños conjuntivales y corneales profundos que se resolvieron parcialmente después de semanas a meses en cuatro casos expuestos a sprays de pimienta, tres de ellos que contenían OC. Un caso solo estuvo expuesto al disolvente, lo que sugiere que este último también causa toxicidad de la superficie ocular causada por los sprays de OC ( Holopainen et al., 2003 ). Los hallazgos de IVCM revelaron activación de queratocitos en el estroma corneal profundo de un caso ( Holopainen et al., 2003 ). Otro estudio informó una reducción significativa en la producción de lágrimas, medida con la prueba de Schirmer, y los síntomas de ojo seco 2 semanas después de la exposición al gas pimienta en pacientes durante una protesta pública en Turquía ( Rasier et al., 2015 ). Un hombre de 75 años desarrolló quemosis conjuntival grave con necrosis, formación de simbléfaron y un defecto epitelial corneal subtotal después de la exposición a capsaicina tópica ( Das et al., 2005 ).
5.2 Cloroacetofenona (CN)
5.2.1 Propiedades químicas
El CN, también conocido como cloruro de fenilacilo y α -CN, se desarrolló después de la Primera Guerra Mundial y se ha utilizado para el control de disturbios y la autodefensa. Sin embargo, se han reportado efectos adversos graves con su uso, incluida la muerte por asfixia pulmonar ( Chapman y White, 1978 ; Ballantyne, 2006 ). Por lo tanto, países como el Reino Unido ya no utilizan CN para operaciones de mantenimiento de la paz. Todavía se utiliza en los Estados Unidos ( Ballantyne, 2006 ). El CN ( C8H7ClO ) tiene un punto de fusión y ebullición de 58 °C – 59 °C y 244 °C–245 °C, respectivamente, y un peso molecular de 154,59. Es soluble en éter, etanol y benceno e insoluble en agua ( Schep et al., 2015 ). El umbral de irritación ocular es de 1,0 mg/ m3 . El CN se vende como MACE ® , una solución de CN al 1% en un disolvente de 5% 1,1,1-tricloroetano, 4% queroseno y Freón 113 ( Blain, 2003 ). Es un polvo micropulverizado que puede causar daños térmicos y mecánicos debido a la fuerza de la explosión y daños químicos en los ojos ( Levine y Stahl, 1968 ). La activación semimáxima de TRPA1 inducida por CN es CE50 CN = 91 ± 12 nM ( Bessac et al., 2009 ).
5.2.2 Mecanismo de toxicidad
CN y CS (Ver Sección 5.3) son agentes alquilantes SN 2 que reaccionan con sitios nucleofílicos, el primero diez veces más potente. Los estudios realizados por Ballantyne y Swanston en 1978 determinaron que la toxicidad inducida por CN es causada por la inactivación de enzimas que contienen tiol y sulfhidrilo, incluyendo la pirúvica descarboxilasa y la glutámico deshidrogenasa ( Blain, 2003 ; Ballantyne, 2006 ). Además, CS también puede inhibir reversiblemente la lactato deshidrogenasa, mientras que CN no puede ( Sanford, 1976 ). Por lo tanto, algunos de los efectos tóxicos causados por estos RCA son causados por la interrupción de las vías metabólicas intracelulares incluyendo la glucólisis y el ciclo del ácido tricarboxílico ( Mackworth, 1948 ; Castro, 1968 ). Estudios en modelos animales mostraron que el CN era el compuesto más tóxico en comparación con el CS, demostrado por la mayor tasa de daño tisular letal en pequeños mamíferos ( Ballantyne y Swanston, 1978 ). Esta reacción provoca la degradación de enzimas relacionadas con la actividad nerviosa sensorial ( Levine y Stahl, 1968 ). El receptor TRPA1, otro canal catiónico permeable al calcio, sodio y potasio, también está presente en las neuronas nociceptoras polimodales y, por lo tanto, puede ser activado por estímulos químicos ( Kaneko y Szallasi, 2014 ; Ruiz-Lozano et al., 2021 ). Los receptores TRPA1 contienen grupos nucleofílicos (es decir, tioles de cisteína) que forman interacciones covalentes con CN, CS y CR, potentes agonistas de estos receptores ( Bautista et al., 2006 ; Brône et al., 2008 ). La transcripción del gen TRPA1 se ha encontrado en las neuronas trigéminas, neuronas ganglionares de la raíz dorsal y nervios corneales de ratones, ratas y humanos ( Brône et al., 2008 ; Canner et al., 2014 ). Bessac et al. informaron una respuesta nula o mínima al dolor en ratones con ablación genética o bloqueo farmacológico de TRPA1, lo que confirma el papel de TRPA1 en la detección del dolor ( Bessac et al., 2009 ). La expresión corneal de TRPA1 también está relacionada con las respuestas fibróticas del factor de crecimiento transformante (TGF)-β1, ya que las córneas de los ratones TRPA−/− permanecieron más transparentes después de una lesión por quemadura alcalina ( Okada et al., 2015 ). Además, la activación de TRPA1 también conduce a un aumento de los niveles corneales de sustancia P, lo que facilita un umbral neuronal de activación más bajo que sensibiliza la córnea a otros estímulos, incluidos los no nocivos ( Zhang et al., 2007 ).
5.2.3 Manifestaciones oculares
En un modelo de conejo, Ballantyne et al. informaron lagrimeo, secreción purulenta, blefaritis, quemosis conjuntival, aumento de la presión intraocular (PIO), hiperemia, iritis, queratitis y neovascularización corneal después de la instilación en el saco conjuntival de 0,1 ml de CN disuelto en polietilenglicol 300 (PEG300) en concentraciones que oscilaban entre el 1% y el 10% ( Ballantyne et al., 1975 ). La gravedad y la duración de las manifestaciones oculares dependían de la concentración, y el 10% de CN causaba iritis moderada, queratitis, cicatrización corneal y neovascularización con una resolución mínima ( Ballantyne et al., 1975 ). Estos resultados fueron respaldados por Gaskins et al., quienes encontraron que >4% de CN disuelto en 1,1,1-tricloroetano causaba daño corneal permanente en conejos ( Gaskins et al., 1972 ).
Oksala et al. describieron cinco casos de lesiones oculares causadas por proyecciones de irritantes en aerosol y uno por pistola de gas lacrimógeno ( Oksala y Salminen, 1975 ). En todos los casos, los pacientes estaban bajo la influencia del alcohol cuando ocurrió el daño. Las manifestaciones oculares fueron eritema palpebral y conjuntival, erosiones epiteliales corneales, edema estromal, pliegues de la membrana de Descemet, formación de pseudopterigión e inflamación de la cámara anterior. La visión solo se restableció parcialmente en la última visita, ya que la mayoría de los casos desarrollaron opacificaciones corneales ( Oksala y Salminen, 1975 ). Los autores sugieren que el daño corneal permanente podría haber sido resultado de un reflejo de parpadeo deteriorado en pacientes ebrios que llevó a una mayor exposición de la superficie ocular y tiempo de contacto con el químico ( Oksala y Salminen, 1975 ). Gerber et al. manejaron a un niño de 2,5 años que fue expuesto accidentalmente a OC desde aproximadamente 30 cm. En la presentación, el examen con lámpara de hendidura fue normal. Sin embargo, 3 semanas después del incidente, se desarrolló la proliferación de tejido conjuntival en el limbo superior y temporal, que posteriormente fue extirpado quirúrgicamente. El examen histopatológico mostró una inflamación mixta aguda y crónica entre las fibras de colágeno. Los autores plantean la hipótesis de que el impacto en los nichos de células madre del limbo puede haber estimulado la proliferación celular y que en este caso será necesaria una vigilancia especial para detectar la deficiencia de células madre del limbo ( Gerber et al., 2011 ).
En animales, se observaron lesiones más leves en la superficie ocular cuando no estaban anestesiados o inmovilizados; por lo tanto, su capacidad para parpadear no se vio afectada ( MacLeod, 1969 ). Además, en todos los casos, la distancia de disparo fue inferior a 1 m y no se proporcionó tratamiento inmediato, lo que dificultó la curación adecuada de la superficie ocular ( Oksala y Salminen, 1975 ). Levine y Stahl evaluaron 14 ojos humanos enucleados después de explosiones de gas lacrimógeno a corta distancia ( Levine y Stahl, 1968 ). Cinco ojos fueron enucleados 2 meses o menos después de la lesión debido a queratitis necrosante e iridociclitis supurativa. Los nueve ojos restantes, enucleados hasta 15 años después de la lesión, exhibieron queratopatía neurotrófica (QN), que provocó neovascularización corneal, ulceración y perforación crónica ( Levine y Stahl, 1968 ). El análisis histológico reveló un engrosamiento del epineuro que resultó en una actividad sensorial deteriorada. Esto último probablemente se debe a la reacción de CN con grupos proteicos sulfhidrilo, inhibición enzimática irreversible y desnaturalización ( Levine y Stahl, 1968 ). La NK da como resultado la ausencia de sensibilidad corneal, lo que conduce a una función trófica deteriorada, regeneración epitelial corneal y mayor riesgo de infección, ulceración y perforación ( Ruiz-Lozano et al., 2021 ).
5.3 Clorobencilideno malononitrilo (CS)
5.3.1 Propiedades químicas
El CS es una molécula electrofílica desarrollada en 1928 por los científicos estadounidenses Corson y Stoughton, de ahí la abreviatura utilizando las primeras letras de sus apellidos ( Olajos y Salem, 2001 ). Sin embargo, no fue utilizado como RCA hasta 1958 por el ejército británico en Chipre, cuando reemplazó al CN como una alternativa más potente pero menos tóxica para el control de multitudes no letal. Este polvo blanco cristalino con una estructura de cianocarbono tiene un punto de fusión de 93ºC y un punto de ebullición de 310ºC. Se hidroliza lentamente en o -clorobenzaldehído y malononitrilo en agua ( O’Neil et al., 2006 ). La concentración de activación semimáxima de CS para el canal TRPA1 es CE50 CS = 7 ± 1 nM ( Bessac et al., 2009 ).
5.3.2 Mecanismo de toxicidad
Anteriormente, los investigadores plantearon la hipótesis de que el CS reaccionaba con glutatión, enzimas que contienen grupos mercapto, grupos tiol de cisteína (presentes en los canales TRPA1), proteínas y ácidos nucleicos ( Olajos y Salem, 2001 ; Committee on Acute Exposure Guideline Levels et al., 2014 ). Sin embargo, ahora se sabe que el CS es un agonista del canal TRPA1, que facilita la liberación de la sustancia P, CGRP y otras sustancias en las terminaciones nerviosas después de la activación ( Brône et al., 2008 ). Esto provoca inflamación neurogénica e hipersensibilidad a estímulos mecánicos y térmicos como parte de la función fisiológica de estas fibras para proteger la córnea del frío nocivo ( Bautista et al., 2006 ).
5.3.3 Manifestaciones oculares
Las manifestaciones más comunes de la exposición al CS incluyen lagrimeo, blefaroespasmo, irritación y conjuntivitis, todas las cuales tienen inicio inmediato ( Kiel, 1997 ; Davey y Moppett, 2004 ). La conjuntivitis y el lagrimeo pueden ocurrir incluso con la exposición indirecta al gas, especialmente si esto sucede en espacios cerrados ( Karaman et al., 2009 ). Curiosamente, algunos agentes de policía han desarrollado características clínicas al manipular elementos contaminados con CS después de entrar en habitaciones previamente ocupadas por detenidos expuestos al gas lacrimógeno. Se han notificado algunos casos de reacciones alérgicas de contacto en los que los pacientes desarrollan un edema palpebral dramático ( Watson y Rycroft, 2005 ). Hill presentó un informe de caso de un hombre rociado directamente con CS en la cara, el pecho y los brazos. Este paciente solo desarrolló edema periorbitario e inyección conjuntival, pero tuvo síntomas respiratorios más graves ( Hill et al., 2000 ). Kiel describe a seis pacientes que se vieron afectados en un bar, donde todos ellos sólo tenían inyección conjuntival y un tiempo de ruptura lagrimal reducido ( Kiel, 1997 ). Parece que el CS tiene manifestaciones clínicas menos graves en comparación con los otros gases lacrimógenos.
5.4 Dibenzoxazepina (CR)
5.4.1 Propiedades químicas
El CR es un sólido cristalino de color amarillo pálido con un punto de fusión de 73ºC. No se hidroliza cuando está en soluciones acuosas y tiene un olor parecido al de la pimienta. Este compuesto tiene propiedades irritantes en concentraciones de 0,0025% o inferiores. Tiene menos efectos respiratorios que el CS pero consecuencias dermatológicas más pronunciadas. Además, permanece más tiempo en el aire y en la ropa que los demás gases lacrimógenos. Por último, tiene una dosis letal media más alta que el CS. Para el CR, la dosis de activación máxima media es EC50 CR = 308 ± 150 nM ( Bessac et al., 2009 ).
5.4.2 Mecanismo de toxicidad
Al igual que el CS y el CN, el CR es un agonista potente y selectivo de los canales de cationes TRPA1 ( Brône et al., 2008 ). El descubrimiento del mecanismo de acción de los otros gases lacrimógenos dependió del estudio del CR y de las fracciones tricíclicas de morfantridina estructuralmente similares ( Gijsen et al., 2010 ).
5.4.3 Manifestaciones oculares
El experimento realizado por Ballantyne et al. (1975) en conejos determinó que una solución >5% CR indujo queratitis transitoria en los animales Ballantyne et al., 1975 . Por otro lado, Rengstorff et al. utilizaron 5% CR en propilenglicol 5 días a la semana durante 4 semanas y encontraron solo conjuntivitis transitoria moderada, pero ninguna alteración anatómica en el examen post mortem de las estructuras corneales y palpebrales ( Rengstorff et al., 1975 ).
En humanos, el CR causa blefaroespasmo intenso, irritación conjuntival y lagrimeo cuando toca la superficie ocular. Es el lacrimógeno más potente de los RCA descritos en esta revisión y tiene la menor toxicidad sistémica. Hasta este punto, Ballantyne y Swanston determinaron que la concentración requerida para provocar blefaroespasmo en humanos es menor para CR que para CS ( Ballantyne y Swanston, 1974 ). El blefaroespasmo impide la apertura de los ojos, pero la agudeza visual (AV) con frecuencia permanece inalterada si los pacientes logran abrir los ojos. En los casos en que se roció a corta distancia y con preparaciones altamente concentradas, pueden ocurrir edema corneal, queratitis necrotizante, iridociclitis y deformidades del ángulo de la cámara anterior ( Leopold y Lieberman, 1971 ; Blain, 2003 ).
6 Complicaciones
Las RCA se asocian con complicaciones de la superficie ocular, incluyendo defectos corneales de curación lenta, opacificación, neovascularización, hipoestesia, disminución de la agudeza visual y enfermedad del ojo seco (EOS) ( Hoffmann, 1967 ; Oksala y Salminen, 1975 ; Epstein y Majmudar, 2001 ; Holopainen et al., 2003 ). Las alteraciones de la agudeza visual van desde visión borrosa transitoria hasta astigmatismo irregular permanente dependiendo de la concentración química y la distancia del impacto, y algunos pacientes se recuperan casi por completo mientras que otros no ( Hoffmann, 1967 ; Kim et al., 2016 ). En el caso de la CN, los estudios en conejos y monos muestran que los animales inoculados directamente desarrollan cicatrización corneal y neovascularización que pueden persistir durante meses ( MacLeod, 1969 ). En un estudio humano realizado por Rose et al., nueve de cada 12 casos expuestos a CN tenían defectos epiteliales que se resolvieron en 3 días, sin embargo, tres de cada 12 pacientes tenían tinción puntiforme corneal confluente que permaneció durante 3 semanas, uno de los cuales tenía opacificación estromal que persistió durante hasta 5 meses ( Rose, 1969 ). Uhde describe casos militares de la Primera Guerra Mundial. En este informe, un paciente desarrolló ceguera permanente secundaria a la explosión a corta distancia de una detonación de granada de CN, mientras que otro que recibió un disparo de una pistola de gas lacrimógeno desarrolló edema corneal, hipopión y también quedó ciego ( Uhde, 1948 ). Algunos de los hallazgos más crónicos en los pacientes evaluados por Oksala incluyeron opacificaciones corneales persistentes, pliegues de Descemet e incluso un pseudopterigión que redujo la agudeza visual en uno de los pacientes ( Oksala y Salminen, 1975 ).
Otras complicaciones graves se pueden encontrar en la literatura ( Midtbo, 1964 ; Blain, 2003 ). El informe de Levine analiza los hallazgos de los casos del Instituto de Patología de las Fuerzas Armadas relacionados con 14 ojos que fueron enucleados después de una lesión por armas de gas lacrimógeno ( Levine y Stahl, 1968 ). La mitad de los casos involucraban soldados que accidentalmente se autoinfligieron sus heridas mientras examinaban botes de gas y otros dispositivos, mientras que la otra mitad fue herida por una segunda persona (agente de la ley) que disparó con la intención de inutilizar. Cinco ojos fueron enucleados dentro de los 2 meses de la lesión, mientras que nueve ojos fueron enucleados entre 8 meses y 15 años después del evento incitador. Los registros médicos indicaron que las córneas de los pacientes estaban opacas, vascularizadas o ulceradas. En particular, las cámaras anteriores de cuatro ojos contenían desechos, pus y también se encontró fibrina, así como hipopión. El glaucoma secundario estaba presente en tres ojos. El examen microscópico de todos los ojos reveló una queratitis necrosante intensa con necrosis coagulativa profunda. Se encontró iridociclitis con restos inflamatorios, aplanamiento de la cámara anterior y membranas retrocorneales ( Levine y Stahl, 1968 ).
Es importante considerar que el CN es más tóxico que el CS, como lo demuestra la prueba realizada por Gaskin et al. En este experimento, se administraron CN y CS en concentraciones comparables (1%–4% y 10%) a córneas y piel de conejos no anestesiados. Los conejos que recibieron CN desarrollaron opacidades corneales además de iritis y conjuntivitis, mientras que los que recibieron CS no desarrollaron lesiones corneales duraderas ( Gaskins et al., 1972 ). Una revisión sistemática identificó síntomas como lagrimeo, blefaroespasmo, conjuntivitis y disminución de la visión. Sin embargo, todos estos efectos tóxicos fueron transitorios y no se informaron manifestaciones crónicas ( Dimitroglou et al., 2015 ). Aunque el CS no produce manifestaciones oculares graves como las otras RCA comentadas en esta revisión, de hecho está asociado con complicaciones respiratorias graves que pueden requerir cuidados intensivos ( Hill et al., 2000 ).
La OC también se asocia con las complicaciones mencionadas anteriormente, así como con quemosis conjuntival, pseudopterigión y queratitis neurotrófica ( Brown et al., 2000 ; Kniestedt et al., 2005 ; Voegeli y Baenninger, 2014 ). Un caso específico de OC con irrigación tardía provocó un deterioro permanente de la agudeza visual relacionado con astigmatismo irregular y opacificación corneal ( Epstein y Majmudar, 2001 ). Un informe de exposición a corta distancia describe una quemadura química ocular grave que resultó en un pseudopterigión con conjuntivalización periférica corneal persistente 6 meses después de la exposición. Este paciente presentó una erosión corneal y microhifema que se trataron con corticosteroides tópicos, antibióticos y lágrimas de suero autólogo. Sin embargo, la erosión persistió en consultas posteriores y, después de 4 semanas, el examen con lámpara de hendidura reveló el pseudopterigión con neovascularización corneal sugestiva de necrosis limbar. La conjuntivalización todavía estaba presente a los 6 meses de la evaluación inicial ( Voegeli y Baenninger, 2014 ). La EOS también es una complicación significativa a largo plazo, como se demostró en un estudio que evaluó la disminución de la producción de lágrimas acuosas después de la exposición al gas pimienta. En este informe, 96 pacientes que estuvieron expuestos a OC durante las protestas de Gezi Parks en Turquía fueron evaluados para EOS utilizando la prueba de Schirmer y el Cuestionario de ojo seco (DEQ). Todos los pacientes fueron tratados mediante irrigación con sustancias alcalinas (leche y soluciones antiácidas). Además, 82 personas informaron haber usado gafas protectoras durante el episodio. Los autores determinaron diferencias estadísticamente significativas entre Schirmer I y II entre los que usaron gafas y los que no (3,21 ± 1,55 a 8,24 ± 1,24 mm p < 0,001; y 5,15 + 1,5 a 13,2 ± 1,66 mm p < 0,001, respectivamente). Además, el 24,4% y el 35,7% de los que usaron y los que no usaron gafas informaron síntomas en el DEQ ( Rasier et al., 2015 ).
Otros estudios mencionan manifestaciones en la superficie no ocular como cataratas, glaucoma, hemorragia vítrea y daño del nervio óptico ( Hoffmann, 1967 ). Sin embargo, es muy probable que la lesión traumática sea la culpable de estas complicaciones, porque los pacientes de estos informes estuvieron expuestos en el contexto de dispositivos explosivos que causan explosiones, daño por ondas de choque o impacto directo de botes de gas lacrimógeno. En la Tabla 1 de esta revisión se presenta un resumen del mecanismo de acción, las manifestaciones oculares y las complicaciones causadas por la exposición a RCA .
7 Gestión de la exposición a RCA
7.1 Descontaminación
El tratamiento de los pacientes expuestos a gases lacrimógenos debe comenzar inmediatamente con la descontaminación del campo. En primer lugar, es vital que los médicos eviten su propia contaminación y la de su equipo. Esto se puede hacer usando gafas protectoras, máscaras quirúrgicas y batas. Los pacientes deben ser levantados del suelo y tratados en espacios bien ventilados, ya que las partículas de gas lacrimógeno pueden acumularse fácilmente ( Carron y Yersin, 2009 ; Schep et al., 2015 ). Se deben quitar las lentes de contacto si es necesario. El paso más importante es la irrigación con agua o solución salina normal durante 15 a 20 minutos para eliminar las partículas de gas lacrimógeno de la superficie ocular ( Breakell y Bodiwala, 1998 ; Blain, 2003 ; Carron y Yersin, 2009 ). En aquellos con blefaroespasmo pronunciado, los anestésicos tópicos pueden facilitar la apertura de los ojos para la irrigación de los fondos de saco superior e inferior , donde pueden acumularse los productos químicos. Históricamente, algunos autores han recomendado soplar aire en los ojos del paciente, pero se ha determinado que esta técnica puede empeorar la sintomatología al dispersar el gas lacrimógeno en zonas no afectadas ( Breakell y Bodiwala, 1998 ; Gray, 2000 ).
7.2 Evaluación oftalmológica
Los pacientes con síntomas oculares moderados a severos justifican la derivación a un oftalmólogo para una evaluación integral ( Kearney et al., 2014 ). La evaluación inicial por parte del oftalmólogo debe incluir un relato de la exposición, para determinar su duración, si fue directa o indirecta y la distancia desde la que se disparó la sustancia. La agudeza visual (AV) debe obtenerse utilizando una tabla de Snellen a 20 pies dentro de una habitación oscura para establecer una medición de referencia. Los pacientes con agudeza visual reducida después de la exposición justifican una evaluación oftalmológica exhaustiva.
El examen con lámpara de hendidura para buscar hiperemia conjuntival, quemosis e inflamación de la piel. La tinción con verde de lisamina debe usarse preferentemente para determinar la extensión del daño del epitelio conjuntival. Un examen corneal debe incluir una evaluación de su integridad epitelial, con tinción con fluoresceína ayudando a detectar erosiones epiteliales ( Brown et al., 2000 ). La fluoresceína también puede ayudar a encontrar úlceras corneales, especialmente en pacientes que presentan dolor severo e hiperemia ( Shimada et al., 2012 ). La cámara anterior debe evaluarse cuidadosamente para detectar signos de una respuesta inflamatoria, como células y erupciones. Las partículas de RCA visiblemente incrustadas se pueden eliminar bajo el biomicroscopio con un hisopo de algodón o una aguja ( Blain, 2003 ).
Es importante evaluar la sensibilidad corneal en visitas de seguimiento, una vez que los síntomas agudos hayan remitido. Los pacientes con hipoestesia están predispuestos a desarrollar úlceras corneales, especialmente si se frotan los ojos ( Holopainen et al., 2003 ; Shimada et al., 2012 ). El estesiómetro de Cochet Bonnet es un instrumento utilizado para medir el umbral de sensibilidad corneal y puede ayudar a los médicos a detectar daño nervioso. Consiste en un monofilamento de nailon de longitud variable que se utiliza para tocar la córnea central y periférica, donde el parpadeo del paciente se considera una respuesta positiva. La prueba debe comenzar utilizando la longitud completa del filamento (60 mm) y continuar con disminuciones de 5 mm hasta obtener una respuesta positiva. Además, otra medición objetiva para evaluar la integridad del nervio corneal es la microscopía confocal in vivo , que permite la visualización directa de las fibras ( Holopainen et al., 2003 ). La combinación de ambas técnicas proporciona un examen exhaustivo de la función sensorial corneal.
7.3 Inhibidores de TRP
El canal TRPA1 es el principal impulsor de la respuesta tisular tras la exposición a CS, CN y CR y su liberación concomitante de neuropéptidos que inducen inflamación. Por lo tanto, algunos estudios que investigan posibles fármacos para bloquear los canales TRPA1 muestran resultados prometedores como tratamiento para los efectos nocivos para la salud de los RCA. Aunque ninguno de estos compuestos está aprobado para el tratamiento de la exposición a los RCA en humanos, estudios previos in vitro y en animales han tenido éxito bloqueando sus efectos.
Por ejemplo, el estudio de Bessac et al. demostró que el influjo de Ca 2+ mediado por TRPA1 media los efectos tóxicos de CS, CN y CR; y que la ablación genética o la inhibición farmacológica del canal TRPA1 disuadieron el comportamiento nocivo inducido por CS o CN. Los resultados in vitro de este experimento determinaron las concentraciones de activación semimáximas para CS, CN y CR, que se mencionaron previamente en la subsección de cada agente. Para la sección in vivo , un grupo de ratones TRPA1−/− ablacionados genéticamente y otro grupo de animales de tipo salvaje que recibieron el antagonista TRPA1 de primera generación HC-030031 fueron expuestos a CS y CN (dosis de 100 mM) por vía ocular o dérmica. Los ratones ablacionados genéticamente no percibieron los gases lacrimógenos como agentes nocivos, lo que se demostró por una abolición total de la respuesta después de su administración. Por otra parte, los ratones de tipo salvaje tratados farmacológicamente tuvieron respuestas nocivas reducidas después de aplicar el antagonista TRPA1 ( Bessac et al., 2009 ). Con base en estos hallazgos, los autores sugirieron que HC-030031 reduce la activación de la vía TRPA1 mediada por gases lacrimógenos inducida por irritación sensorial aguda.
En humanos, las compañías biofarmacéuticas han realizado ensayos clínicos de fase temprana que investigan la eficacia del antagonismo de TRPA1 en otras afecciones clínicas, como el dolor neuropático y el asma alérgico. Recientemente se publicó un ensayo clínico de fase dos, aleatorizado, controlado y doble ciego que evalúa el bloqueador de TRPA1 ISC-17536 (Glenmark Pharmaceuticals) como monoterapia para la neuropatía diabética dolorosa ( Agarwal et al., 2014 ). ISC-17536 no mostró una eficacia significativa en el tratamiento de la neuropatía periférica diabética. Aun así, los autores plantean la hipótesis de que, dado que el sitio de acción farmacológico está en las fibras nerviosas periféricas pequeñas, es poco probable que los pacientes que han perdido estas neuronas respondan a la inhibición de TRPA1. Sin embargo, podría observarse un efecto en aquellos que han conservado las fibras nerviosas pequeñas ( Jain et al., 2022 ). Los ensayos clínicos que estudian otras moléculas, como HX-100 , GDC-0334 y ODM-108, para el asma alérgico y el dolor neuropático se han detenido debido a una farmacocinética desfavorable ( Chen y Terrett, 2020 ; Souza Monteiro De Araujo et al., 2020 ).
El bloqueo de TRPV1 también puede eliminar eficazmente los síntomas oculares de dolor. Aunque no se ha estudiado el bloqueo de TRPV1 en la exposición a RCA, ha reducido el dolor y la inflamación ocular en otros contextos clínicos. Por ejemplo, en un modelo murino desarrollado por Fakih et al., los ratones DED que recibieron capsazepina, un antagonista tópico de TRPV1, dos veces al día durante 2 semanas mostraron inhibición de genes comúnmente regulados positivamente involucrados en el dolor inflamatorio y neuropático. Este experimento también demostró una sensación reducida de dolor ocular ( Fakih et al., 2021 ). En otro modelo de queratoconjuntivitis alérgica, el pretratamiento de ratones con antagonistas de TRPV1 redujo la reacción inflamatoria y previno la sensibilización de los nociceptores, lo que resultó en una disminución del dolor ocular ( Callejo et al., 2015 ).
7.4 Agentes quelantes
La solución de Diphotérine ® (Laboratorio Prevor, Valmondois, Francia) es una sustancia hipertónica, anfótera y quelante recomendada para la exposición dérmica u ocular a diversos productos químicos ( Gerard et al., 2002 ; Rihawi et al., 2006 ; Dohlman et al., 2011 ). Este compuesto tiene seis sitios de unión que permiten la depuración de diferentes sustancias, incluidos ácidos, bases y agentes alquilantes, entre otros ( Hall et al., 2002 ). Gerard et al. trataron con éxito a un paciente con quemaduras químicas oculares graves después de enjuagar el ojo con 1 L de Diphotérine y evitaron el desarrollo de secuelas ( Gerard et al., 2002 ). Es importante destacar que el enjuague con Diphotérine redujo el edema estromal del paciente, un factor de riesgo que se ha correlacionado con la gravedad de los leucomas posteriores ( Kubota y Fagerholm, 1991 ). Viala et al. realizó un experimento en el que cinco gendarmes franceses entraron voluntariamente en una cámara con concentraciones de CS de 3.000 mg/m3 . Cuatro de ellos desarrollaron rápidamente síntomas incapacitantes, que se resolvieron en 4 min después de salir de la cámara y ser descontaminados con 250 ml de Diphotérine. Uno de los gendarmes se aplicó la solución antes de entrar en la cámara, y su único síntoma fue una tos leve que también se resolvió después de unos minutos ( Viala et al., 2005 ). Los resultados que obtuvo Brvar años después apoyan aún más el uso de Diphotérine, en un experimento en el que agentes de policía eslovenos en formación corrieron durante 20 s a través de una nube generada por granadas de CS en un campo abierto. Los agentes que se rociaron Diphotérine antes de la exposición al CS tuvieron niveles más bajos de dolor facial y pudieron volver al servicio más rápidamente. Los tratados con la solución después del ejercicio también se recuperaron de sus síntomas, aunque no tan rápidamente; Finalmente, aquellos que no recibieron tratamiento reportaron los niveles más altos de dolor y estuvieron incapacitados por más tiempo ( Brvar, 2016 ).
8 Conclusión
Los gases lacrimógenos pueden ser más nocivos de lo que se pensaba inicialmente. Aunque en muchos casos las manifestaciones clásicas de conjuntivitis, lagrimeo y blefaroespasmo son transitorias, esta revisión revela que pueden existir secuelas mucho más graves que requieran derivación y seguimiento oftalmológico. Gran parte de la literatura disponible proviene de informes de casos y series de casos. Estos documentos tienen un bajo nivel de importancia epidemiológica. Aun así, las complicaciones descritas en ellos deben alertar a la comunidad médica sobre la necesidad de un conocimiento más profundo de los efectos de los gases lacrimógenos. Además, la base de la atención actualmente se basa en la descontaminación mediante irrigación. Se han realizado algunos esfuerzos para desarrollar antídotos específicos, pero ninguno ha sido liberado con éxito al público. Para comprender completamente las secuelas a largo plazo, se necesitan esfuerzos de investigación más exhaustivos y desarrollar tratamientos específicos para cada objetivo. Se deben implementar pautas terapéuticas formales para estandarizar el tratamiento de los pacientes expuestos y proteger al equipo médico de la contaminación.
Contribuciones del autor
Diseño del trabajo: MQ-G y RR-L. Conceptualización: MQ-G, RR-L y VP. Investigación y selección de literatura: MQ-G, RR-L y JS-L. Redacción principal: MQ-G y NA. Revisión del manuscrito: MQ-G, RR-L y HM. Edición de figuras: MQ-G, NA y SK. Revisión crítica: VP. Coordinación del proyecto: VP. Todos los autores leyeron y aprobaron la versión final del manuscrito.
Incompatibilidad
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda evaluarse en este artículo, o cualquier afirmación que pueda hacer su fabricante, no está garantizada ni respaldada por el editor.
Referencias
Agarwal, S., Angayarkanni, N., Iyer, G., Srinivasan, B., Natarajan, R., Charola, S., et al. (2014). Correlación clínico-bioquímica del efecto del bevacizumab subconjuntival en la neovascularización corneal. Cornea 33, 1016–1021. doi:10.1097/ICO.0000000000000198
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Alamri, AS, Wood, RJ, Ivanusic, JJ y Brock, JA (2018). Neuroquímica y morfología de los nociceptores polimodales corneales y termorreceptores del frío identificados funcionalmente. PLoS One 13, e0195108. doi:10.1371/journal.pone.0195108
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ballantyne, B., Gazzard, MF, Swanston, DW y Williams, P. (1975). Toxicología oftálmica comparativa de la 1-cloroacetofenona (CN) y la dibenz(bf)-1:4-oxazepina(CR). Arch. Toxicol. 34, 183–201. doi:10.1007/bf00353282
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ballantyne, B. (2006). Tratamiento médico de las consecuencias traumáticas de los incidentes de disturbios civiles: causas, enfoques clínicos, necesidades y criterios de planificación avanzada. Toxicol. Rev. 25, 155–197. doi:10.2165/00139709-200625030-00003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ballantyne, B. y Swanston, DW (1978). Toxicidad aguda comparativa en mamíferos de 1-cloroacetofenona (CN) y 2-clorobencilideno malononitrilo (CS). Arch. Toxicol. 40, 75–95. doi:10.1007/BF01891962
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ballantyne, B., y Swanston, DW (1974). Efectos irritantes de soluciones diluidas de dibenzoxazepina (CR) en los ojos y la lengua. Acta Pharmacol. Toxicol. (Copenh) 35, 412–423. doi:10.1111/j.1600-0773.1974.tb00762.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bates, BD, Mitchell, K., Keller, JM, Chan, CC, Swaim, WD, Yaskovich, R., et al. (2010). Respuesta analgésica prolongada de la córnea a la resiniferatoxina tópica, un potente agonista de TRPV1. Pain 149, 522–528. doi:10.1016/j.pain.2010.03.024
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bautista, DM, Jordt, SE, Nikai, T., Tsuruda, PR, Read, AJ, Poblete, J., et al. (2006). TRPA1 media las acciones inflamatorias de los irritantes ambientales y los agentes proalgésicos. Cell. 124, 1269–1282. doi:10.1016/j.cell.2006.02.023
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Belmonte, C., Acosta, MC, Merayo-Lloves, J., y Gallar, J. (2015). ¿Qué causa el dolor ocular? Curr. Ophthalmol. Rep. 3, 111–121. doi:10.1007/s40135-015-0073-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Belmonte, C., Nichols, JJ, Cox, SM, Brock, JA, Begley, CG, Bereiter, DA, et al. (2017). Informe de dolor y sensación de TFOS DEWS II. Ocul. Navegar. 15, 404–437. doi:10.1016/j.jtos.2017.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bessac, BF, Sivula, M., Von Hehn, CA, Caceres, AI, Escalera, J., y Jordt, SE (2009). Los antagonistas de la anquirina 1 con potencial transitorio del receptor bloquean los efectos nocivos de los isocianatos industriales tóxicos y los gases lacrimógenos. Faseb J. 23, 1102–1114. doi:10.1096/fj.08-117812
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Blain, PG (2003). Gases lacrimógenos e incapacitantes irritantes. 1-cloroacetofenona, 2-clorobencilideno malononitrilo y dibenz[b, f]-1, 4-oxazepina. Toxicol. Rev. 22, 103–110. doi:10.2165/00139709-200322020-00005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Breakell, A. y Bodiwala, GG (1998). Exposición al gas CS en un club nocturno lleno de gente: consecuencias para un servicio de urgencias y accidentes. J. Accid. Emerg. Med. 15, 56–57. doi:10.1136/emj.15.1.56
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Brône, B., Peeters, PJ, Marrannes, R., Mercken, M., Nuydens, R., Meert, T., et al. (2008). Los gases lacrimógenos CN, CR y CS son activadores potentes del receptor TRPA1 humano. Toxicol. Appl. Pharmacol. 231, 150–156. doi:10.1016/j.taap.2008.04.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Brown, L., Takeuchi, D. y Challoner, K. (2000). Abrasiones corneales asociadas con la exposición al gas pimienta. Am. J. Emerg. Med. 18, 271–272. doi:10.1016/s0735-6757(00)90120-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Brvar, M. (2016). Exposición al gas lacrimógeno clorobencilideno malononitrilo: enjuague con solución anfótera, hipertónica y quelante. Hum. Exp. Toxicol. 35, 213–218. doi:10.1177/0960327115578866
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Callejo, G., Castellanos, A., Castany, M., Gual, A., Luna, C., Acosta, MC, et al. (2015). Los canales iónicos sensibles al ácido detectan acidificaciones moderadas para inducir dolor ocular. Dolor 156, 483–495. doi:10.1097/01.j.pain.0000460335.49525.17
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Canner, JP, Linsenmayer, TF y Kubilus, JK (2014). Regulación del desarrollo del TRPA1 trigémino por la córnea. Invest. Ophthalmol. Vis. Sci. 56, 29–36. doi:10.1167/iovs.14-15035
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Carron, PN y Yersin, B. (2009). Gestión de los efectos de la exposición a gases lacrimógenos. Bmj 338, b2283. doi:10.1136/bmj.b2283
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Castro, JA (1968). Efectos de los agentes alquilantes de la colinesterasa plasmática humana: el papel de los grupos sulfhidrilo en su centro activo. Biochem. Pharmacol. 17, 295–303. doi:10.1016/0006-2952(68)90333-x
Chapman, AJ y White, C. (1978). Muerte por agentes lacrimógenos. J. Forensic Sci. 23, 10702J–11530J. doi:10.1520/jfs10702j
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Chen, H. y Terrett, JA (2020). Antagonistas del receptor de potencial transitorio ankyrin 1 (TRPA1): una revisión de patentes (2015-2019). Opinión de expertos. Ther. Pat. 30, 643–657. doi:10.1080/13543776.2020.1797679
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Comité de Niveles Directrices de Exposición AgudaComité de ToxicologíaJunta de Estudios Ambientales y ToxicologíaDivisión de Estudios de la Tierra y la VidaConsejo Nacional de Investigación (2014). Niveles de referencia de exposición aguda para sustancias químicas transportadas por el aire seleccionadas: Volumen 16 . Washington (DC): National Academies Press US .
Das, S., Chohan, A., Snibson, GR y Taylor, HR (2005). Lesión ocular causada por pulverización de Capsicum. Int. Ophthalmol. 26, 171–173. doi:10.1007/s10792-006-9025-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Davey, A. y Moppett, IK (2004). Complicaciones posoperatorias después de la exposición a aerosoles de CS. Anaesthesia 59, 1219–1220. doi:10.1111/j.1365-2044.2004.03927.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Dimitroglou, Y., Rachiotis, G. y Hadjichristodoulou, C. (2015). Exposición al agente antidisturbios CS y posibles efectos sobre la salud: una revisión sistemática de la evidencia. Int. J. Environ. Res. Public Health 12, 1397–1411. doi:10.3390/ijerph120201397
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Dohlman, CH, Cade, F. y Pfister, R. (2011). Quemaduras químicas en el ojo: cambios de paradigma en el tratamiento. Cornea 30, 613–614. doi:10.1097/ICO.0b013e3182012a4f
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Epstein, RJ y Majmudar, PA (2001). Gas pimienta en el ojo. Ophthalmology 108, 1712–1713. doi:10.1016/s0161-6420(01)00732-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Fakih, D., Guerrero-Moreno, A., Baudouin, C., Réaux-Le Goazigo, A. y Parsadaniantz, SM (2021). La capsazepina disminuye el síndrome de dolor corneal en la enfermedad grave del ojo seco. J. Neuroinflammation 18, 111. doi:10.1186/s12974-021-02162-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Forrester, MB y Stanley, SK (2003). Epidemiología de las exposiciones a gas pimienta notificadas en Texas entre 1998 y 2002. Vet. Hum. Toxicol. 45, 327–330.
Frey, AS, Maniscalco, PM y Holstege, CP (2022). Agentes químicos encontrados en protestas. Emerg. Med. Clin. North Am. 40, 365–379. doi:10.1016/j.emc.2022.01.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gallar, J., Pozo, MA, Rebollo, I., y Belmonte, C. (1990). Efectos de la capsaicina en la cicatrización de heridas corneales. Invest. Ophthalmol. Vis. Sci. 31, 1968–1974.
Gaskins, JR, Hehir, RM, Mccaulley, DF y Ligon, EW (1972). Agentes lacrimógenos (CS y CN) en ratas y conejos. Efectos agudos en la boca, los ojos y la piel. Arch. Environ. Health 24, 449–454. doi:10.1080/00039896.1972.10666123
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gerard, M., Merle, H., Chiambaretta, F., Rigal, D. y Schrage, N. (2002). Un enjuague anfótero utilizado en el tratamiento de emergencia de una quemadura ocular grave. Burns 28, 670–673. doi:10.1016/s0305-4179(02)00094-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gerber, S., Frueh, BE y Tappeiner, C. (2011). Proliferación conjuntival después de una lesión leve por gas pimienta en un niño pequeño. Cornea 30, 1042–1044. doi:10.1097/ICO.0b013e318206cad9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gijsen, HJ, Berthelot, D., Zaja, M., Brône, B., Geuens, I. y Mercken, M. (2010). Análogos de la morfantridina y del gas lacrimógeno dibenz[b, f] [1, 4]oxazepina (CR) como activadores extremadamente potentes del canal humano de potencial transitorio del receptor anquirina 1 (TRPA1). J. Med. Chem. 53, 7011–7020. doi:10.1021/jm100477n
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gray, PJ, Stark, MM y Jones, GRN (2000). ¿Es peligroso el CS en aerosol? La formulación afecta la toxicidad. Bmj 321, 46–47. doi:10.1136/bmj.321.7252.46
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gummin, DD, Mowry, JB, Spyker, DA, Brooks, DE, Osterthaler, KM y Banner, W. (2018). Informe anual de 2017 del Sistema Nacional de Datos sobre Envenenamientos (NPDS) de la Asociación Estadounidense de Centros de Control de Envenenamientos: 35.º informe anual. Clin. Toxicol. (Filadelfia) 56, 1213–1415. doi:10.1080/15563650.2018.1533727
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Haar, RJ, Iacopino, V., Ranadive, N., Weiser, SD y Dandu, M. (2017). Impactos en la salud de los irritantes químicos utilizados para el control de multitudes: una revisión sistemática de las lesiones y muertes causadas por gases lacrimógenos y gas pimienta. BMC Public Health 17, 831. doi:10.1186/s12889-017-4814-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Hall, AH, Blomet, J. y Mathieu, L. (2002). Diphotérina para la descontaminación emergente por salpicaduras químicas en ojos y piel: una revisión. Vet. Hum. Toxicol. 44, 228–231.
Hill, AR, Silverberg, NB, Mayorga, D. y Baldwin, HE (2000). Riesgos médicos del gas lacrimógeno CS. Un caso de reacción de hipersensibilidad persistente y multisistémica y revisión de la literatura. Med. Baltim. 79, 234–240. doi:10.1097/00005792-200007000-00004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Hoffmann, DH (1967). Quemaduras oculares causadas por gas lacrimógeno. Br. J. Ophthalmol. 51, 265–268. doi:10.1136/bjo.51.4.265
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Holopainen, JM, Moilanen, JA, Hack, T. y Tervo, TM (2003). Los portadores tóxicos en aerosoles de pimienta pueden causar erosión corneal. Toxicol. Appl. Pharmacol. 186, 155–162. doi:10.1016/s0041-008x(02)00015-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Hu, H., Fine, J., Epstein, P., Kelsey, K., Reynolds, P. y Walker, B. (1989). ¿Agente acosador de gas lacrimógeno o arma química tóxica? Jama 262, 660–663. doi:10.1001/jama.262.5.660
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ifantides, C., Deitz, GA, Christopher, KL, Slingsby, TJ y Subramanian, PS (2020). Armas menos letales que provocan lesiones oftálmicas: una revisión y un ejemplo reciente de traumatismo ocular. Oftalmol. Ther. 9, 1–7. doi:10.1007/s40123-020-00271-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ilgaz, A., Uyanusta Fç, K., Arbak, P., Müezzinoğlu, A., Çiftçi, TU, Akpınar, S., et al. (2019). Amplia exposición a gases lacrimógenos en Ankara. Torác turco. J. 20, 108-113. doi:10.5152/TurkThoracJ.2018.18096
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Jain, SM, Balamurugan, R., Tandon, M., Mozaffarian, N., Gudi, G., Salhi, Y., et al. (2022). Ensayo aleatorizado, doble ciego, controlado con placebo de ISC 17536, un inhibidor oral del receptor de potencial transitorio anquirina 1, en pacientes con neuropatía periférica diabética dolorosa: impacto de la función preservada de las fibras nerviosas pequeñas. Pain 163, e738–e747. doi:10.1097/j.pain.0000000000002470
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kaneko, Y., y Szallasi, A. (2014). Canales de potencial transitorio del receptor (TRP): una perspectiva clínica. Br. J. Pharmacol. 171, 2474–2507. doi:10.1111/bph.12414
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Karaman, E., Erturan, S., Duman, C., Yaman, M. y Duman, GU (2009). Obstrucción laríngea y bronquial aguda tras la inhalación de gas CS (o-clorobencilidenemalononitrilo). Eur. Arch. Otorhinolaryngol. 266, 301–304. doi:10.1007/s00405-008-0653-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kearney, T., Hiatt, P., Birdsall, E. y Smollin, C. (2014). Gravedad de las lesiones causadas por gas pimienta: experiencia de diez años en un sistema de control de intoxicaciones. Prehosp Emerg. Care 18, 381–386. doi:10.3109/10903127.2014.891063
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kiel, AW (1997). Exposición ocular al gas CS: la importancia de un tratamiento temprano correcto. Eye (Londres) 11 (5), 759–760. doi:10.1038/eye.1997.194
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kim, YJ, Payal, AR y Daly, MK (2016). Efectos de los gases lacrimógenos en los ojos. Surv. Ophthalmol. 61, 434–442. doi:10.1016/j.survophthal.2016.01.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kniestedt, C., Fleischhauer, J., Stürmer, J. y Thiel, MA (2005). Lesiones por spray de pimienta del segmento anterior del ojo. Klín. Monbl Augenheilká 222, 267–270. doi:10.1055/s-2005-857978
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Krishnatreyya, H., Hazarika, H., Saha, A. y Chattopadhyay, P. (2018a). Capsaicina, el componente principal de los aerosoles de pimienta y sus efectos farmacológicos en los tejidos oculares de los mamíferos. Eur. J. Pharmacol. 819, 114–121. doi:10.1016/j.ejphar.2017.11.042
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Krishnatreyya, H., Hazarika, H., Saha, A. y Chattopadhyay, P. (2018b). Expresiones farmacológicas fundamentales sobre la exposición ocular a la capsaicina, el componente principal de los aerosoles de pimienta. Sci. Rep. 8, 12153. doi:10.1038/s41598-018-30542-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kubota, M. y Fagerholm, P. (1991). Quemadura corneal por álcali en el conejo. Balance hídrico, curación y transparencia. Acta Ophthalmol. (Copenh) 69, 635–640. doi:10.1111/j.1755-3768.1991.tb04852.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kumar, V., Sur, VP, Guha, R., Konar, A. y Hazra, S. (2018). El estrógeno modula la nocicepción corneal y mantiene la homeostasis corneal en el ojo de rata. Cornea 37, 508–514. doi:10.1097/ICO.0000000000001437
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Lambiase, A., Aloe, L., Mantelli, F., Sacchetti, M., Perrella, E., Bianchi, P., et al. (2012). La denervación sensorial corneal inducida por capsaicina y el deterioro de la cicatrización se revierten mediante el tratamiento con NGF. Invest. Ophthalmol. Vis. Sci. 53, 8280–8287. doi:10.1167/iovs.12-10593
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Levine, RA y Stahl, CJ (1968). Lesiones oculares causadas por armas de gas lacrimógeno. Am. J. Ophthalmol. 65, 497–508. doi:10.1016/0002-9394(68)93863-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Mackworth, JF (1948). Inhibición de las enzimas tiol por lacrimógenos. Biochem. J. 42, 82–90. doi:10.1042/bj0420082
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Marfurt, CF, Cox, J., Deek, S. y Dvorscak, L. (2010). Anatomía de la inervación corneal humana. Exp. Eye Res. 90, 478–492. doi:10.1016/j.exer.2009.12.010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Menezes, RG, Hussain, SA, Rameez, MA, Kharoshah, MA, Madadin, M., Anwar, N., et al. (2016). Agentes químicos de control de multitudes. Medicina. Pierna. J. 84, 22-25. doi:10.1177/0025817215622314
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Midtbo, A. (1964). Lesión ocular por gas lacrimógeno. Acta Ophthalmol. (Copenh) 42, 672–679. doi:10.1111/j.1755-3768.1964.tb00917.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Okada, Y., Reinach, PS, Shirai, K., Kitano-Izutani, A., Miyajima, M., Yamanaka, O., et al. (2015). Canales de receptores de potencial transitorio e inflamación del estroma corneal. Cornea 34 (11), S136–S141. doi:10.1097/ICO.0000000000000602
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Oksala, A. y Salminen, L. (1975). Lesiones oculares causadas por armas de mano con gas lacrimógeno. Acta Ophthalmol. (Copenh) 53, 908–913. doi:10.1111/j.1755-3768.1975.tb00410.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Olajos, EJ, y Salem, H. (2001). Agentes antidisturbios: farmacología, toxicología, bioquímica y química. J. Appl. Toxicol. 21, 355–391. doi:10.1002/jat.767
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Olajos, EJ, y Stopford, W. (2004). Agentes de control de disturbios: cuestiones de toxicología, seguridad y salud . Boca Raton, Fla: CRC Press .
O’neil, MJ, Smith, A. y Heckelman, PE (2006). El índice Merck: una enciclopedia de productos químicos, fármacos y productos biológicos . Whitehouse Station, NJ, EE. UU.: Merck and Co. Inc. , 977.
Rasier, R., Kukner, AS, Sengul, EA, Yalcin, NG, Temizsoylu, O. y Bahcecioglu, HO (2015). La disminución de la producción de lágrimas acuosas asociada con el gas pimienta. Curr. Eye Res. 40, 429–433. doi:10.3109/02713683.2014.930156
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rengstorff, RH, Petrali, JP, Mershon, MM y Sim, VM (1975). El efecto del agente antidisturbios dibenz(b, f)-1, 4-oxazepina (CR) en el ojo del conejo. Toxicol. Appl. Pharmacol. 34, 45–48. doi:10.1016/0041-008x(75)90173-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rihawi, S., Frentz, M. y Schrage, NF (2006). Tratamiento de emergencia de quemaduras oculares: ¿Qué solución de enjuague debemos elegir? Graefes Arch. Clin. Exp. Ophthalmol. 244, 845–854. doi:10.1007/s00417-005-0034-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rothenberg, C., Achanta, S., Svendsen, ER y Jordt, SE (2016). Gas lacrimógeno: una reevaluación epidemiológica y mecanicista. Ann. NY Acad. Sci. 1378, 96–107. doi:10.1111/nyas.13141
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ruiz-Lozano, RE, Hernandez-Camarena, JC, Loya-Garcia, D., Merayo-Lloves, J., y Rodriguez-Garcia, A. (2021). Base molecular de la queratopatía neurotrófica: implicaciones diagnósticas y terapéuticas. Una revisión. Ocul. Surf. 19, 224–240. doi:10.1016/j.jtos.2020.09.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sanford, JP (1976). Aspectos médicos de los agentes de control de disturbios (acoso). Annu. Rev. Med. 27, 421–429. doi:10.1146/annurev.me.27.020176.002225
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Schep, LJ, Slaughter, RJ y Mcbride, DI (2015). Agentes de control de disturbios: los gases lacrimógenos CN, CS y OC: una revisión médica. JR Army Med. Corps 161, 94–99. doi:10.1136/jramc-2013-000165
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Shimada, M., Young, C. y Tanen, DA (2012). Úlcera corneal asociada a la exposición a gas pimienta durante el entrenamiento militar. J. Emerg. Med. 43, e149. doi:10.1016/j.jemermed.2011.07.028
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Smith, J., y Greaves, I. (2002). El uso de aerosoles químicos incapacitantes: una revisión. J. Trauma 52, 595–600. doi:10.1097/00005373-200203000-00036
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sorkin, LS, Eddinger, KA, Woller, SA y Yaksh, TL (2018). Orígenes de la actividad antidrómica en las fibras aferentes sensoriales y la inflamación neurogénica. Semin. Inmunopatología. 40, 237–247. doi:10.1007/s00281-017-0669-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Souza Monteiro De Araujo, D., Nassini, R., Geppetti, P. y De Logu, F. (2020). TRPA1 como diana terapéutica para el dolor nociceptivo. Opinión de expertos. Ther. Targets 24, 997–1008. doi:10.1080/14728222.2020.1815191
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Tidwell, RD y Wills, BK (2019). Toxicidad del gas lacrimógeno y el gas pimienta . Treasure Island, FL: StatPearls Publishing .
Toprak, S., Ersoy, G., Hart, J. y Clevestig, P. (2015). La patología de la exposición letal a los agentes antidisturbios: hacia una metodología basada en la ciencia forense para determinar el uso indebido. J. Forensic Leg. Med. 29, 36–42. doi:10.1016/j.jflm.2014.11.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Uhde, GI (1948). Lesiones oculares causadas por los llamados gases de guerra que no causan víctimas; informe de casos. Am. J. Ophthalmol. 31, 323–327. doi:10.1016/0002-9394(48)91160-x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Vaca, FE, Myers, JH y Langdorf, M. (1996). Edema pulmonar retardado y broncoespasmo después de exposición accidental a lagrimales. Am. J. Emerg. Med. 14, 402–405. doi:10.1016/S0735-6757(96)90060-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Varma, S., y Holt, PJ (2001). Reacción cutánea grave al gas CS. Clin. Exp. Dermatol 26, 248–250. doi:10.1046/j.1365-2230.2001.00806.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Vesaluoma, M., Müller, L., Gallar, J., Lambiase, A., Moilanen, J., Hack, T., et al. (2000). Efectos del aerosol de pimienta con oleorresina de capsicum sobre la morfología y sensibilidad de la córnea humana. Invest. Ophthalmol. Vis. Sci. 41, 2138–2147.
Viala, B., Blomet, J., Mathieu, L. y Hall, AH (2005). Prevención de los efectos del gas lacrimógeno CS en los ojos y la piel y descontaminación activa con difotérina: estudios preliminares en cinco gendarmes franceses. J. Emerg. Med. 29, 5–8. doi:10.1016/j.jemermed.2005.01.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Voegeli, S., y Baenninger, PB (2014). Quemadura química grave en el ojo después de un ataque con gas pimienta. Klin. Monbl Augenheilkd 231, 327–328. doi:10.1055/s-0034-1368286
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Watson, K. y Rycroft, R. (2005). Reacciones cutáneas no deseadas a la pulverización de CS. Contact Dermat. 53, 9–13. doi:10.1111/j.0105-1873.2005.00585.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Organización Mundial de la Salud (1970). Aspectos sanitarios de las armas químicas y biológicas: Informe de un grupo de consultores de la OMS. Disponible en: https://apps.who.int/iris/handle/10665/39444 .
Yeung, MF y Tang, WY (2015). Efectos clinicopatológicos de la pulverización de pimienta (oleoresina de capsicum). Hong Kong Med. J. 21, 542–552. doi:10.12809/hkmj154691
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Zhang, F., Yang, H., Wang, Z., Mergler, S., Liu, H., Kawakita, T., et al. (2007). La activación transitoria del receptor de vanilloide 1 induce la liberación de citocinas inflamatorias en el epitelio corneal a través de la señalización de MAPK. J. Cell. Physiol. 213, 730–739. doi:10.1002/jcp.21141
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Zollman, TM, Bragg, RM y Harrison, DA (2000). Efectos clínicos de la oleorresina de capsicum (spray de pimienta) en la córnea y la conjuntiva humanas. Oftalmología 107, 2186–2189. doi:10.1016/s0161-6420(00)00463-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: agentes antidisturbios, gases lacrimógenos, toxicidad, oleorresina de capsicum, clorobencilideno malononitrilo, inflamación neurogénica, superficie ocular
Cita: Quiroga-Garza ME, Ruiz-Lozano RE, Azar NS, Mousa HM, Komai S, Sevilla-Llorca JL y Perez VL (2023) Efectos nocivos de los agentes antidisturbios en la superficie ocular: mecanismos patogénicos y manejo. Front.Toxicol. 5:1118731. doi: 10.3389/ftox.2023.1118731
Recibido: 07 de diciembre de 2022; Aceptado: 04 de enero de 2023;
Publicado: 17 de enero de 2023.
Editado por:
Anat Galor , Universidad de Miami, Estados Unidos
Revisado por:
Maryam Akhgari , Organización Iraní de Medicina Legal, Irán
Arianna Giorgetti , Universidad de Bolonia, Italia
Copyright © 2023 Quiroga-Garza, Ruiz-Lozano, Azar, Mousa, Komai, Sevilla-Llorca y Pérez. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution (CC BY). Se permite su uso, distribución o reproducción en otros foros, siempre que se acredite al autor original y al propietario del copyright y se cite la publicación original en esta revista, de acuerdo con la práctica académica aceptada. No se permite ningún uso, distribución o reproducción que no cumpla con estos términos.
*Correspondencia: Victor L. Perez, victor.perez.quinones@duke.edu
Descargo de responsabilidad: todas las afirmaciones expresadas en este artículo son únicamente de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. El editor no garantiza ni respalda ningún producto que pueda evaluarse en este artículo ni ninguna afirmación que pueda hacer su fabricante.